













• •
曹星新1, 李艾亦2, 侯婧涵1, 李明学1, 李艳艳1, 靳玮华1, 杨凤梅1, 段素琴1, 和占龙1( )
)
收稿日期:2025-02-25
修回日期:2025-04-07
出版日期:2025-10-06
作者简介:曹星新(2001—),男,硕士研究生,研究方向:疾病动物模型及药理学。E-mail:s2024018001@student.pumc.edu.cn;基金资助:
CAO Xingxin1, LI Aiyi2, HOU Jinghan1, LI Mingxue1, LI Yanyan1, JIN Weihua1, YANG Fengmei1, DUAN Suqin1, HE Zhanlong1( )
)
Received:2025-02-25
Revised:2025-04-07
Published:2025-10-06
Contact:
HE Zhanlong (ORCID: 0000-0001-5379-2521), E-mail: hzl@imbcams.com.cn摘要:
目的 基于系统综述和荟萃分析优先报告条目(Preferred Reporting Items for Systematic Reviews and Meta - Analysis,PRISMA)指南,利用Meta分析(meta-analysis)对文献报告中利用动物实验研究黄芪(纯黄芪制剂)或其成分治疗急性胰腺炎(acute pancreatitis,AP)的药理药效结果进行定量合并,以获得精准可靠的综合效应结论。 方法 检索中国知网(China National Knowledge Infrastructure,CNKI)、维普中文科技期刊数据库(VIP Database for Chinese Technical Periodicals,VIP)、万方数据知识服务平台(Wanfang Data Knowledge Service Platform)、中国生物医学文献数据库(China Biomedical Literature Database,CBMdisc)、PubMed以及 Web of Science(WOS)数据库中从建库初始到2025年3月关于黄芪(纯黄芪制剂)或其成分治疗AP的动物实验相关文献。对于纳入文献使用SYRCLE工具进行偏倚风险评估;对于各研究间的异质性评估遵循Cochrane手册,采用Cochrane's Q检验和I2 统计量进行评价。 结果 本文共检索得到297篇文献,经筛选及评价后最终纳入19项动物实验进行Meta分析。这19篇文献涵盖了SD大鼠、C57BL/6小鼠、BALB/c小鼠和昆明小鼠四个品系,SYRCLE评分为3~4分,Egger's test检验结果为P<0.05,Cochrane's Q检验和I2 统计量显示研究间异质性较大。Meta分析19项动物实验相关文献的结果显示,纯黄芪制剂(黄芪注射液)能降低AP特异性指标血清淀粉酶(serum amylase,AMS)的含量;黄芪成分可以降低AMS与脂肪酶(lipase,LPS)的水平。黄芪注射液或黄芪成分可降低血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1 beta,IL-1β)的水平,升高白细胞介素-10(interleukin-10,IL-10)的水平;升高血清中超氧化物歧化酶(superoxide dismutase,SOD)与谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)的水平,降低丙二醛(malondialdehyde,MDA)的水平。黄芪注射液或黄芪成分的高剂量组相较低剂量组更能降低AMS、TNF-α和IL-6的水平,同时升高SOD的水平,但未证明剂量高低对MDA水平的影响。 结论 动物实验结果的循证学分析显示,在SD大鼠、C57BL/6小鼠、BALB/c小鼠、昆明小鼠等多种动物模型中,黄芪注射液或黄芪成分能有效降低AP特异性指标(AMS、LPS)的表达或分泌水平,其机制可能与部分炎症介质有关,包括降低TNF-α、IL-6和IL-1β的水平,升高IL-10的水平;同时也可能干预氧化/抗氧化平衡过程,如升高SOD和GSH-PX的水平,降低MDA的水平;除MDA外,黄芪注射液或黄芪成分对于降低AMS、TNF-α和IL-6水平以及升高SOD水平呈现剂量相关性。但由于现有研究中存在较高的异质性、一定的发表偏倚风险、动物模型与人类疾病之间的种属差异等问题,未来仍需进一步开展高质量的临床试验或动物实验研究。
中图分类号:
曹星新,李艾亦,侯婧涵,等.黄芪或其成分治疗急性胰腺炎的动物实验Meta分析[J]. 实验动物与比较医学.. DOI: 10.12300/j.issn.1674-5817.2025.026.
CAO Xingxin,LI Aiyi,HOU Jinghan,et al. Meta-Analysis of Animal Experiments on Astragali Radix or Its Ingredients for Acute Pancreatitis[J]. Laboratory Animal and Comparative Medicine. DOI: 10.12300/j.issn.1674-5817.2025.026.
第一作者 (发表年份) First author (Publication date) | 动物 数量# Animal number# | 造模方法 Experimental animal & modeling method | 干预措施 Intervene measure | 采样时间 Sampling time | SYRCLE评分 Score of SYRCLE | 研究指标 Research indicators | |
|---|---|---|---|---|---|---|---|
黄芪或其成分组 Astragali radix or its ingredients group | 对照组 Control group | ||||||
孙海燕 (2006)[ SUN H Y (2006) | 10/10 | SD大鼠,雌性,14∼15周龄,体重(200±20) g;胆胰管开口处逆行注入脱氧胆酸钠0.25%,0.5 mL/kg | 造模前皮下注射黄芪总皂苷80 mg/kg 2次,间隔1 h,末次给药30 min后造模 | 皮下注射生理盐水10 mL/kg | 造模后 6 h和12 h | 4 | ①② |
傅强 (2006)[ FU Q (2006) | 20/20 | 昆明小鼠,雌性,体重(25±3) g;腹腔注射雨蛙素50 g/kg,间隔1 h,连续6次,末次注射后,腹腔注射脂多糖10 mg/kg | 末次造模注射后经尾静脉注射黄芪注射液0.5 mL/只 | 末次造模注射后经尾静脉注射等体积生理盐水 | 给药2、6、12、24 h后 | 3 | ① |
郭文学 (2008)[ GUO W X (2008) | 8/8 | SD大鼠,雄性,体重(250±30) g;经胰胆管逆行注射5%牛磺胆酸钠0.11 mL/100 g,速度为0.24 mL/min | 术后即刻注射黄芪注射液 3 mL/100 g,并以2 mL/ 100(g•h-1)维持 | 相同方法注射等体积生理盐水 | 给药2、6、12 h后 | 3 | ①②⑦⑧ |
朱渊红 (2009)[ ZHU Y H (2009) | 24/24 | SD大鼠,雌雄各半,体重(250±20) g;经胰胆管逆行注射3.5%牛磺胆酸钠(1 mL/kg) | 造模前24、12 h及造模后注射黄芪注射液0.4 mL/100 g | 无 | 造模后 6、9、12 h | 3 | ① |
朱渊红 (2012)[ ZHU YH (2012) | 8/8 | SD大鼠,雌雄各半,体重(250±20) g;胰胆管穿刺3.5%磺胆酸钠(1 mL/kg)注射 | 造模前24、12 h及造模后分别于大鼠尾静脉注射黄芪注射液0.2 mL/100 g及0.4 mL/100 g | 无 | 造模后 6 h | 3 | ⑦⑧ |
邱雷 (2014)[ QIU L (2014) | 21/21 | SD大鼠,雄性,体重180∼200 g; 胰胆管穿刺注射4%磺胆酸钠 (1 mL/kg) | 造模前12 h和2 h黄芪甲苷 40 mg/kg腹腔注射 | 无 | 造模后 24 h | 3 | ①②③④⑤ |
王少言 (2014)[ WANG S Y (2014) | 15/15 | SD大鼠,雄性,12∼16周龄,体重250∼300 g;胰胆管穿刺注射5%磺胆酸钠(1 mL/kg) | 造模前12 h黄芪注射液 0.2 mL/100 g | 等体积 生理盐水 | 造模后 6 h | 3 | ⑦⑧⑨ |
邱雷 (2015)[ QIU L (2015) | 18/18 | SD大鼠,雄性,体重(250±30)g;4%磺胆酸钠(0.1 mL/100 g)逆行胆胰管注射;腹腔注射20% L-精氨酸(3 mg/kg)2次,间隔1 h | 黄芪甲苷溶于DMSO后造模前2 h给予50 mg/kg | 等体积 DMSO | 造模后 12、24、48 h | 3 | ①②③④⑤ |
王秉均 (2016)[ WANG B J (2016) | 8/8 | 雌雄各半,SD大鼠,体重180∼220 g;胰胆管穿刺注射5%磺胆酸钠 (1 mL/kg) | 造模后立即单次黄芪多糖800 mg/kg灌胃 | 等体积 生理盐水 | 造模后 12 h | 4 | ①③⑦ |
郑洋 (2016)[ ZHENG Y (2016) | 10/10 | 雌雄各半,SD大鼠50只,体重(180 ±20) g;胰胆管穿刺注射5%磺胆酸钠 | 造模后黄芪注射液2 mL/kg注射6 h/次,共4次 | 等体积 生理盐水 | 造模后 24 h | 3 | ③④⑥⑦⑧ |
郑蓓蓓 (2017)[ ZHENG B B (2017) | 15/15 | 成年雄性SD大鼠,体重220~250 g;胰胆管穿刺注射5%磺胆酸钠 | 造模后腹腔注射300 mg/kg黄芪多糖 | 等体积 生理盐水 | 造模后 24 h | 3 | ③④ |
MA R (2018) [ | 20/20 | 雄性BALB/c小鼠,8∼10周龄,体重(20±2) g;腹腔内注射雨蛙肽(50 μg/kg),1次/h,连续8 h | 雨蛙肽给药前1 h腹腔注射25 mg/kg、50 mg/kg毛蕊异黄酮 | 等体积 生理盐水 | 注射雨蛙肽后16 h | 3 | ①②③④ ⑥⑦⑧ |
吴爱详(2019)[ WU A X (2019) | 20/20 | 昆明小鼠,6∼8周龄,体重(20.02 ± 2.65) g;腹腔注射20% L-精氨酸3 mg/kg,首次注射1 h后再注射1次 | 灌胃黄芪甲苷200 mg/kg,2 次/d,连续干预7 d | 等体积 生理盐水 | 给药 结束后 | 3 | ①②④ |
ZHU C J (2021)[ | 6/6 | C57BL/6 N小鼠,雄性,鼠龄8∼10周,体重18∼22 g;小鼠每小时腹腔注射4 g/kg L-精氨酸,持续2 h | 第一次注射L-精氨酸前1 h,腹腔注射毛蕊异黄酮25 mg/kg或50 mg/kg | 等体积 生理盐水 | 造模后 | 3 | ①②④ |
金玲玲(2021)[ JIN L L (2021) | 20/20 | SD大鼠,6周龄,体重220∼250 g,雌雄不限;胰胆管注射3.5%牛磺胆酸钠 | 造模后腹腔注射20 mg/kg、 40 mg/kg黄芪总皂苷,给药体积为10 mL/kg | 等体积 生理盐水 | 给药后 24 h | 3 | ① |
王欣 (2022)[ WANG X (2022) | 20/20 | C57BL/6小鼠,6~8周龄,体重为18 ~ 22 g;腹腔注射pH=7,20% L-精氨酸2.5 mg/kg,以此间隔1 h注射2次 | 造模后黄芪总皂100 mg/kg灌胃1次/d,连续7 d | 无 | 末次给药后24 h | 3 | ①⑦⑧⑨ |
洪春霞(2023)[ HONG C X (2023) | 8/8 | SD大鼠,体重为220~250 g;造模前禁食12 h,不禁水,麻醉经胰胆管穿刺后,3.5%牛黄胆酸按1 mL/kg在微量泵恒压下匀速注射 | 造模前12 h、24 h、造模后即刻、造模后12 h及24 h分别给予(0.10、0.15、0.20) mL/(100 g·d-1)黄芪注射液经尾静脉注射 | 无 | 末次给药 后6 h | 3 | ①③ |
李振国(2024)[ LI Z G (2024) | 20/20 | SD大鼠,成年雄性,体重200~220 g胆管穿刺注射5%磺胆酸钠 (1 mL/kg) | 造模后每天给予黄芪多糖 400 mg/kg,持续灌胃2周 | 等体积 生理盐水 | 造模后2周 | 3 | ③④⑤ |
| HOU X T (2024) [ | 6/6 | 昆明小鼠,7周龄,体重(35±2.5) g;胆胰管开口经十二指肠壁逆行注射脱氧胆酸钠(2.5%,0.5 mL/kg) | 小鼠后肢皮下注射黄芪总皂苷(20、40、80 mg/kg)两次,每隔1 h给药 | 10 mL/kg 生理盐水 | 造模后6、12、24 h | 3 | ①⑦⑧ |
表1 纳入文献的基本特征
Table 1 Basic characteristic of included studies
第一作者 (发表年份) First author (Publication date) | 动物 数量# Animal number# | 造模方法 Experimental animal & modeling method | 干预措施 Intervene measure | 采样时间 Sampling time | SYRCLE评分 Score of SYRCLE | 研究指标 Research indicators | |
|---|---|---|---|---|---|---|---|
黄芪或其成分组 Astragali radix or its ingredients group | 对照组 Control group | ||||||
孙海燕 (2006)[ SUN H Y (2006) | 10/10 | SD大鼠,雌性,14∼15周龄,体重(200±20) g;胆胰管开口处逆行注入脱氧胆酸钠0.25%,0.5 mL/kg | 造模前皮下注射黄芪总皂苷80 mg/kg 2次,间隔1 h,末次给药30 min后造模 | 皮下注射生理盐水10 mL/kg | 造模后 6 h和12 h | 4 | ①② |
傅强 (2006)[ FU Q (2006) | 20/20 | 昆明小鼠,雌性,体重(25±3) g;腹腔注射雨蛙素50 g/kg,间隔1 h,连续6次,末次注射后,腹腔注射脂多糖10 mg/kg | 末次造模注射后经尾静脉注射黄芪注射液0.5 mL/只 | 末次造模注射后经尾静脉注射等体积生理盐水 | 给药2、6、12、24 h后 | 3 | ① |
郭文学 (2008)[ GUO W X (2008) | 8/8 | SD大鼠,雄性,体重(250±30) g;经胰胆管逆行注射5%牛磺胆酸钠0.11 mL/100 g,速度为0.24 mL/min | 术后即刻注射黄芪注射液 3 mL/100 g,并以2 mL/ 100(g•h-1)维持 | 相同方法注射等体积生理盐水 | 给药2、6、12 h后 | 3 | ①②⑦⑧ |
朱渊红 (2009)[ ZHU Y H (2009) | 24/24 | SD大鼠,雌雄各半,体重(250±20) g;经胰胆管逆行注射3.5%牛磺胆酸钠(1 mL/kg) | 造模前24、12 h及造模后注射黄芪注射液0.4 mL/100 g | 无 | 造模后 6、9、12 h | 3 | ① |
朱渊红 (2012)[ ZHU YH (2012) | 8/8 | SD大鼠,雌雄各半,体重(250±20) g;胰胆管穿刺3.5%磺胆酸钠(1 mL/kg)注射 | 造模前24、12 h及造模后分别于大鼠尾静脉注射黄芪注射液0.2 mL/100 g及0.4 mL/100 g | 无 | 造模后 6 h | 3 | ⑦⑧ |
邱雷 (2014)[ QIU L (2014) | 21/21 | SD大鼠,雄性,体重180∼200 g; 胰胆管穿刺注射4%磺胆酸钠 (1 mL/kg) | 造模前12 h和2 h黄芪甲苷 40 mg/kg腹腔注射 | 无 | 造模后 24 h | 3 | ①②③④⑤ |
王少言 (2014)[ WANG S Y (2014) | 15/15 | SD大鼠,雄性,12∼16周龄,体重250∼300 g;胰胆管穿刺注射5%磺胆酸钠(1 mL/kg) | 造模前12 h黄芪注射液 0.2 mL/100 g | 等体积 生理盐水 | 造模后 6 h | 3 | ⑦⑧⑨ |
邱雷 (2015)[ QIU L (2015) | 18/18 | SD大鼠,雄性,体重(250±30)g;4%磺胆酸钠(0.1 mL/100 g)逆行胆胰管注射;腹腔注射20% L-精氨酸(3 mg/kg)2次,间隔1 h | 黄芪甲苷溶于DMSO后造模前2 h给予50 mg/kg | 等体积 DMSO | 造模后 12、24、48 h | 3 | ①②③④⑤ |
王秉均 (2016)[ WANG B J (2016) | 8/8 | 雌雄各半,SD大鼠,体重180∼220 g;胰胆管穿刺注射5%磺胆酸钠 (1 mL/kg) | 造模后立即单次黄芪多糖800 mg/kg灌胃 | 等体积 生理盐水 | 造模后 12 h | 4 | ①③⑦ |
郑洋 (2016)[ ZHENG Y (2016) | 10/10 | 雌雄各半,SD大鼠50只,体重(180 ±20) g;胰胆管穿刺注射5%磺胆酸钠 | 造模后黄芪注射液2 mL/kg注射6 h/次,共4次 | 等体积 生理盐水 | 造模后 24 h | 3 | ③④⑥⑦⑧ |
郑蓓蓓 (2017)[ ZHENG B B (2017) | 15/15 | 成年雄性SD大鼠,体重220~250 g;胰胆管穿刺注射5%磺胆酸钠 | 造模后腹腔注射300 mg/kg黄芪多糖 | 等体积 生理盐水 | 造模后 24 h | 3 | ③④ |
MA R (2018) [ | 20/20 | 雄性BALB/c小鼠,8∼10周龄,体重(20±2) g;腹腔内注射雨蛙肽(50 μg/kg),1次/h,连续8 h | 雨蛙肽给药前1 h腹腔注射25 mg/kg、50 mg/kg毛蕊异黄酮 | 等体积 生理盐水 | 注射雨蛙肽后16 h | 3 | ①②③④ ⑥⑦⑧ |
吴爱详(2019)[ WU A X (2019) | 20/20 | 昆明小鼠,6∼8周龄,体重(20.02 ± 2.65) g;腹腔注射20% L-精氨酸3 mg/kg,首次注射1 h后再注射1次 | 灌胃黄芪甲苷200 mg/kg,2 次/d,连续干预7 d | 等体积 生理盐水 | 给药 结束后 | 3 | ①②④ |
ZHU C J (2021)[ | 6/6 | C57BL/6 N小鼠,雄性,鼠龄8∼10周,体重18∼22 g;小鼠每小时腹腔注射4 g/kg L-精氨酸,持续2 h | 第一次注射L-精氨酸前1 h,腹腔注射毛蕊异黄酮25 mg/kg或50 mg/kg | 等体积 生理盐水 | 造模后 | 3 | ①②④ |
金玲玲(2021)[ JIN L L (2021) | 20/20 | SD大鼠,6周龄,体重220∼250 g,雌雄不限;胰胆管注射3.5%牛磺胆酸钠 | 造模后腹腔注射20 mg/kg、 40 mg/kg黄芪总皂苷,给药体积为10 mL/kg | 等体积 生理盐水 | 给药后 24 h | 3 | ① |
王欣 (2022)[ WANG X (2022) | 20/20 | C57BL/6小鼠,6~8周龄,体重为18 ~ 22 g;腹腔注射pH=7,20% L-精氨酸2.5 mg/kg,以此间隔1 h注射2次 | 造模后黄芪总皂100 mg/kg灌胃1次/d,连续7 d | 无 | 末次给药后24 h | 3 | ①⑦⑧⑨ |
洪春霞(2023)[ HONG C X (2023) | 8/8 | SD大鼠,体重为220~250 g;造模前禁食12 h,不禁水,麻醉经胰胆管穿刺后,3.5%牛黄胆酸按1 mL/kg在微量泵恒压下匀速注射 | 造模前12 h、24 h、造模后即刻、造模后12 h及24 h分别给予(0.10、0.15、0.20) mL/(100 g·d-1)黄芪注射液经尾静脉注射 | 无 | 末次给药 后6 h | 3 | ①③ |
李振国(2024)[ LI Z G (2024) | 20/20 | SD大鼠,成年雄性,体重200~220 g胆管穿刺注射5%磺胆酸钠 (1 mL/kg) | 造模后每天给予黄芪多糖 400 mg/kg,持续灌胃2周 | 等体积 生理盐水 | 造模后2周 | 3 | ③④⑤ |
| HOU X T (2024) [ | 6/6 | 昆明小鼠,7周龄,体重(35±2.5) g;胆胰管开口经十二指肠壁逆行注射脱氧胆酸钠(2.5%,0.5 mL/kg) | 小鼠后肢皮下注射黄芪总皂苷(20、40、80 mg/kg)两次,每隔1 h给药 | 10 mL/kg 生理盐水 | 造模后6、12、24 h | 3 | ①⑦⑧ |
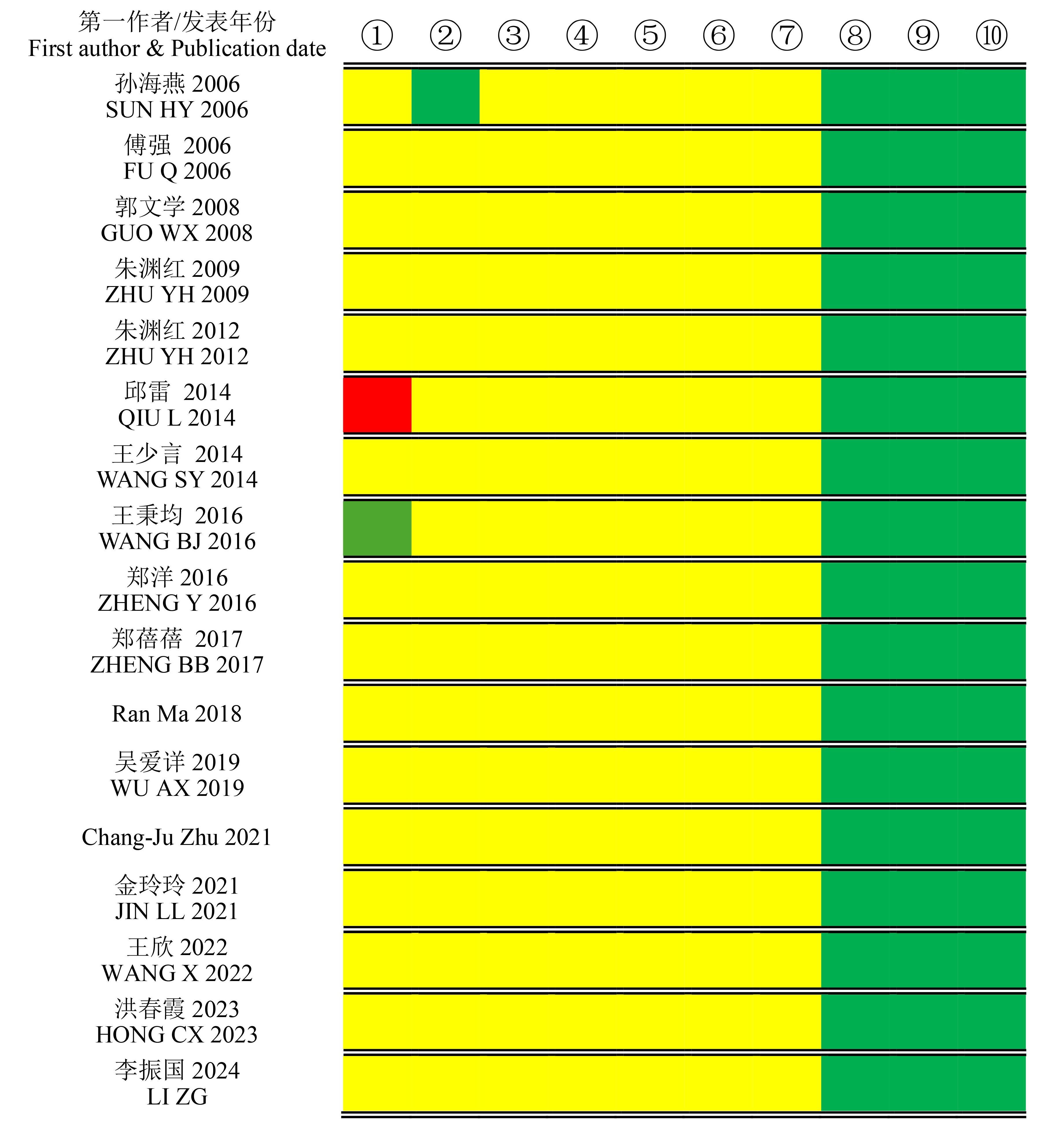
图2 纳入文献的SYRCLE评分偏倚风险图注:绿色(低偏倚风险)、红色(高偏倚风险)、黄色(不确定偏倚风险)。①序列生成(随机化),②基线特征可比性,③分配隐藏,④随机化安置,⑤随机化饲养,⑥盲法实验,⑦随机化结果评估,⑧不完整数据报告,⑨选择性结果报告,⑩其他偏倚。
Figure 2 Risk of bias graph of SYRCLE ratings for the included studiesNote: Green, low risk; Red, high risk; Yellow, unclear risk. ① Sequence generation (randomization), ② Baseline characteristic comparability, ③ Allocation concealment, ④ Random housing, ⑤ Random feeding ⑥ Blinding (experiment), ⑦ Random outcome assessment, ⑧ Incomplete data reporting, ⑨ Selective outcome reporting, ⑩ Other sources of bias.
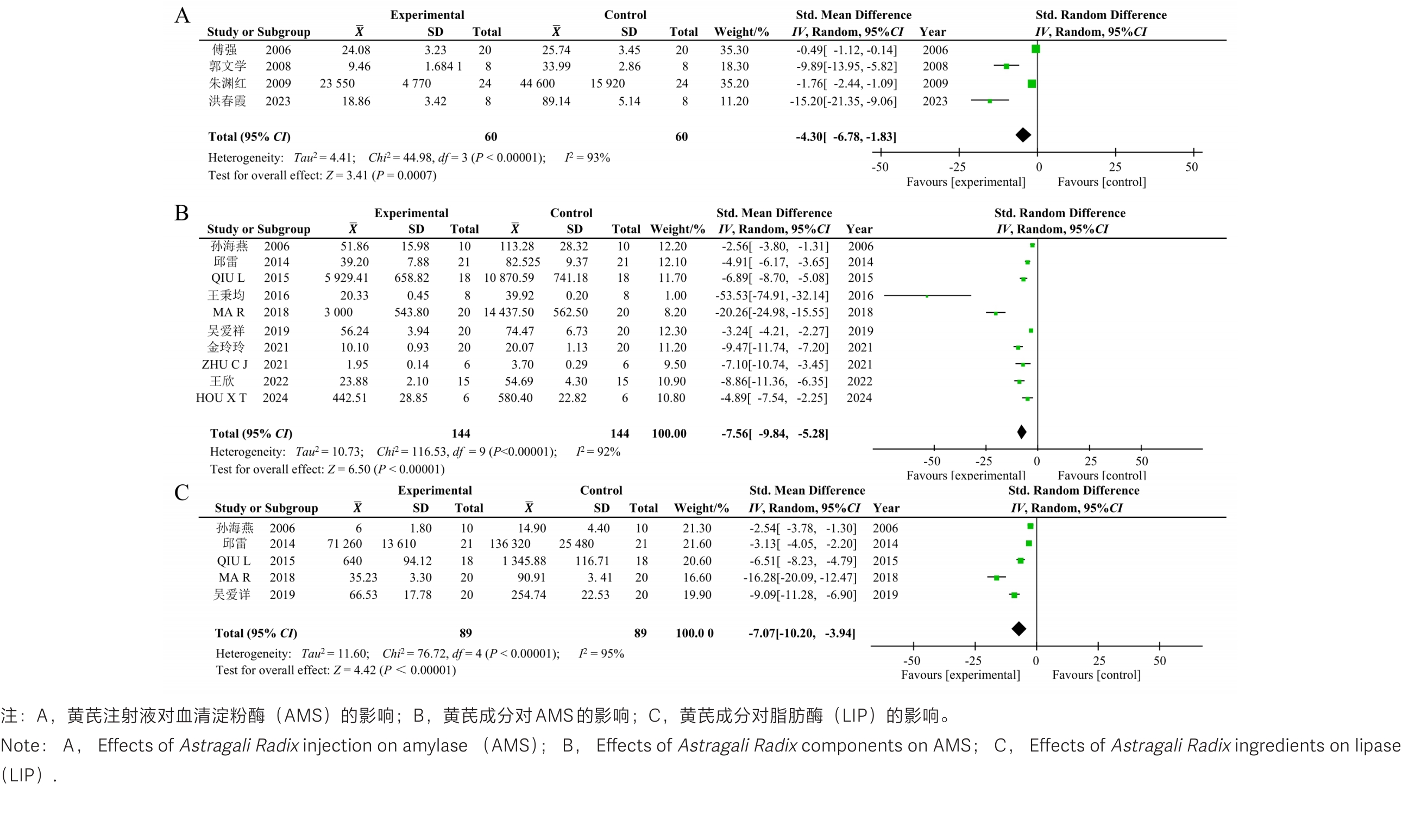
图3 黄芪或其成分治疗急性胰腺炎后有关实验动物临床指标的Meta分析森林图
Figure 3 Forest plot of the meta-analysis on clinical parameters in experimental animals with acute pancreatitis after treatment with Astragali Radix or its ingredients.
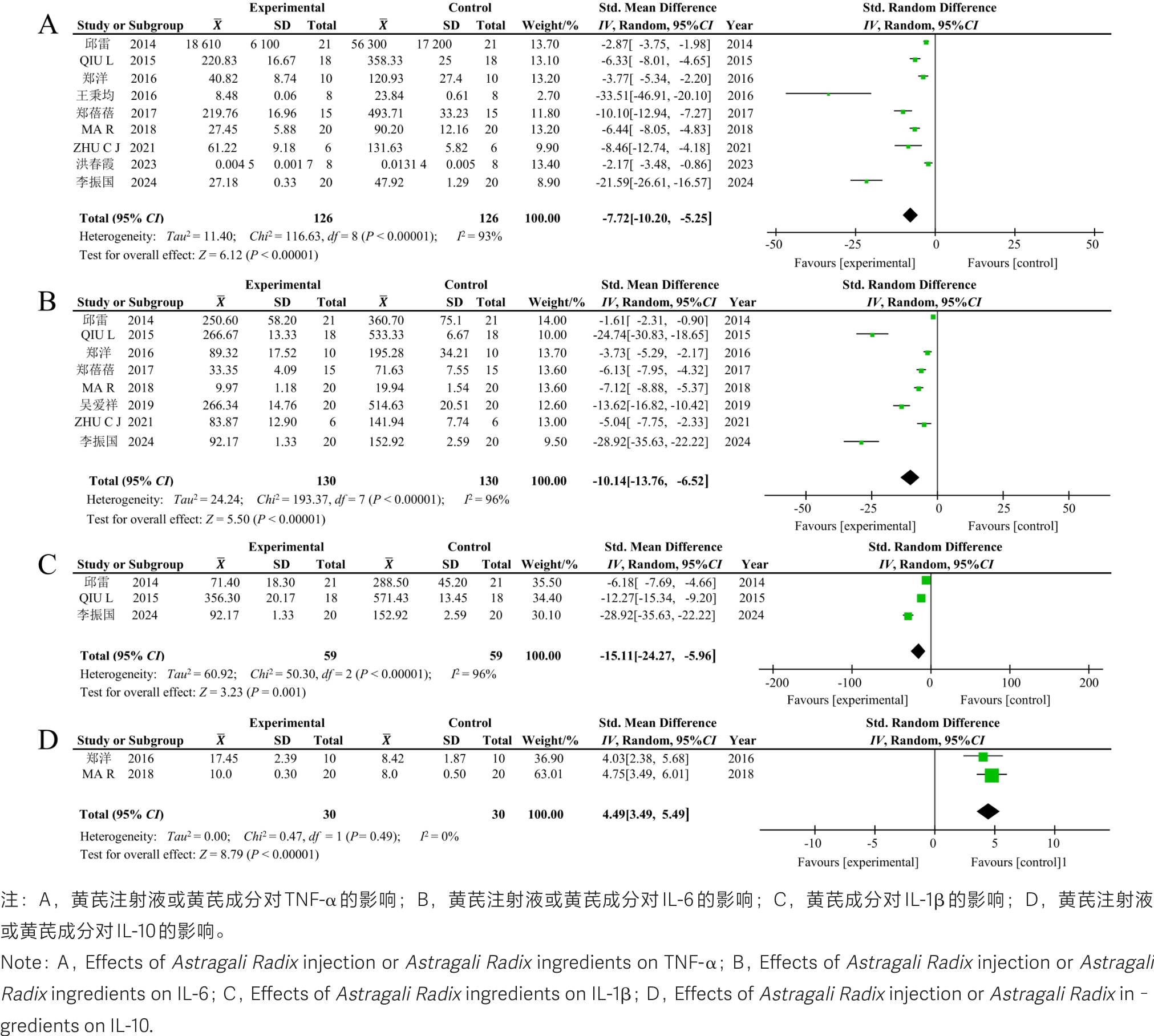
图4 黄芪或其成分治疗急性胰腺炎后有关实验动物炎症因子的Meta分析森林图
Figure 4 Forest plot of the meta-analysis on inflammatory mediator in experimental animals with acute pancreatitis after treatment with Astragali Radix or its ingredients.
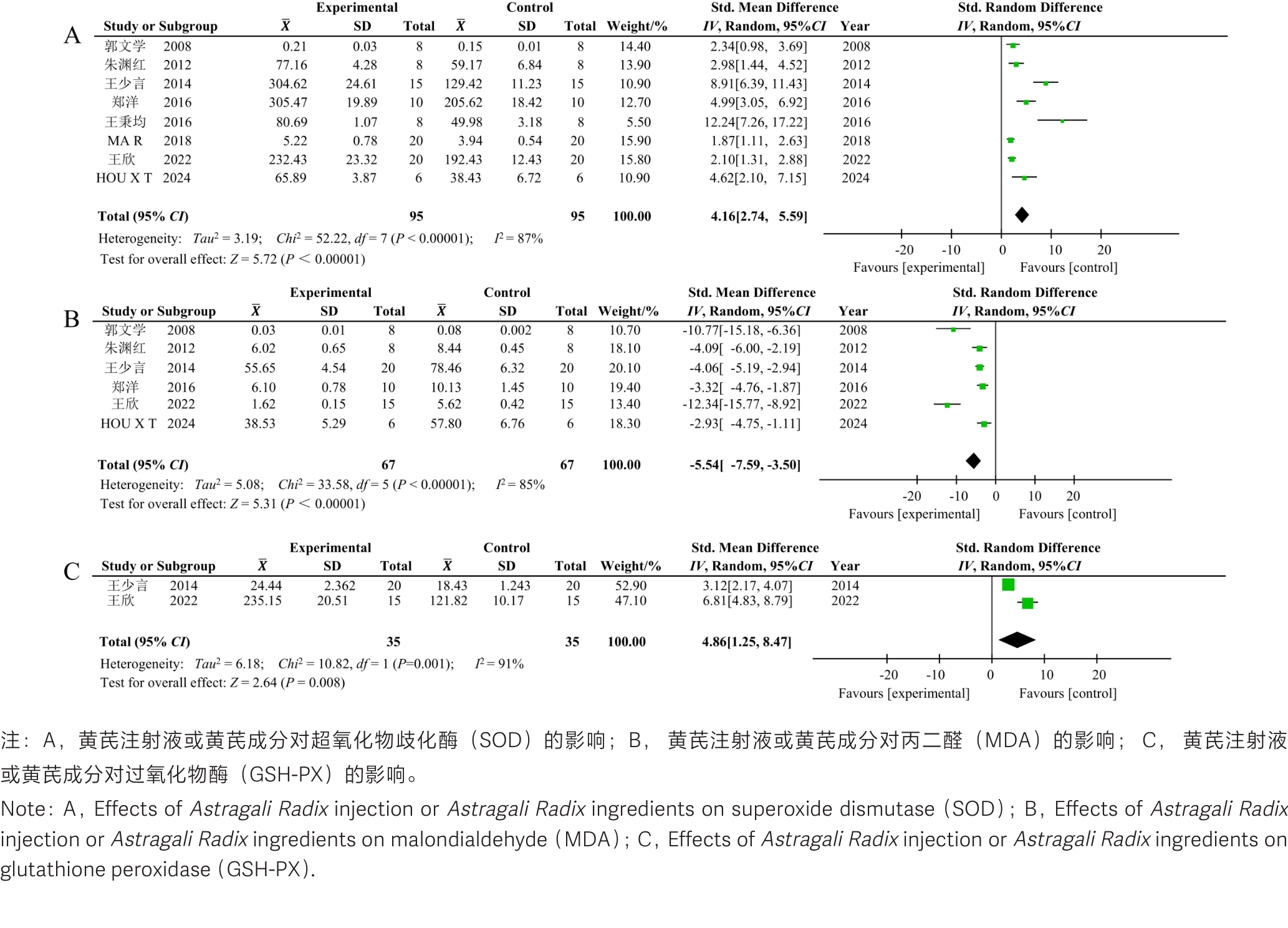
图5 黄芪注射液或黄芪成分治疗急性胰腺炎后有关实验动物氧化/抗氧化平衡过程的Meta分析森林图
Figure 5 Forest plot of the meta-analysis on oxidative & antioxidant equilibrium in experimental animals with acute pancreatitis after treatment with Astragali Radix injection or the ingredients of Astragali Radix
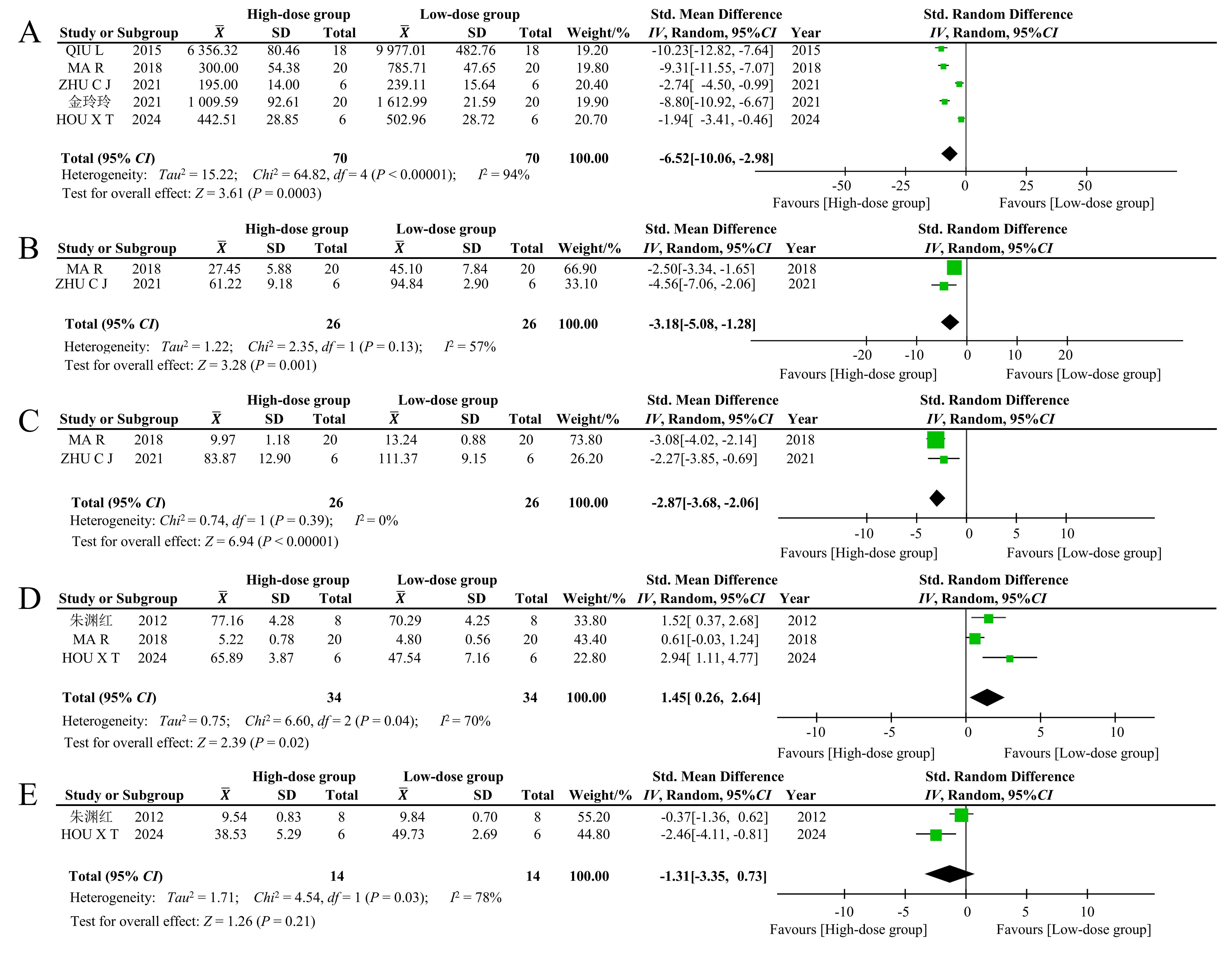
图6 不同剂量的黄芪注射液或其成分治疗急性胰腺炎后有关实验动物临床病病理指标的Meta分析森林图注:A,不同剂量的黄芪注射液或其成分对血清淀粉酶(AMS)的影响;B,不同剂量的黄芪注射液或其成分对TNF-α的影响;C,不同剂量的黄芪注射液或其成分对IL-6的影响;D,不同剂量的黄芪注射液或其成分对超氧化物歧化酶(SOD)的影响;E,不同剂量的黄芪注射液或其成分对丙二醛(MDA)的影响。
Figure 6 Forest plot of a Meta-analysis on clinicopathological indicators in experimental animals after treatment of acute pancreatitis with different doses of Astragali Radix injection or Astragali Radix ingredientsNote: A, Effects of different doses of Astragali Radix injection or Astragali Radix ingredients on serum amylase (AMS); B, Effects of different doses of Astragali Radix injection or Astragali Radix ingredients on TNF-α; C, Effects of different doses of Astragali Radix injection or Astragali Radix ingredients on IL-6; D, Effects of different doses of Astragali Radix injection or Astragali Radix ingredients on superoxide dismutase (SOD); E, Effects of different doses ofAstragali Radix injection or Astragali Radix ingredients on malondialdehyde (MDA)
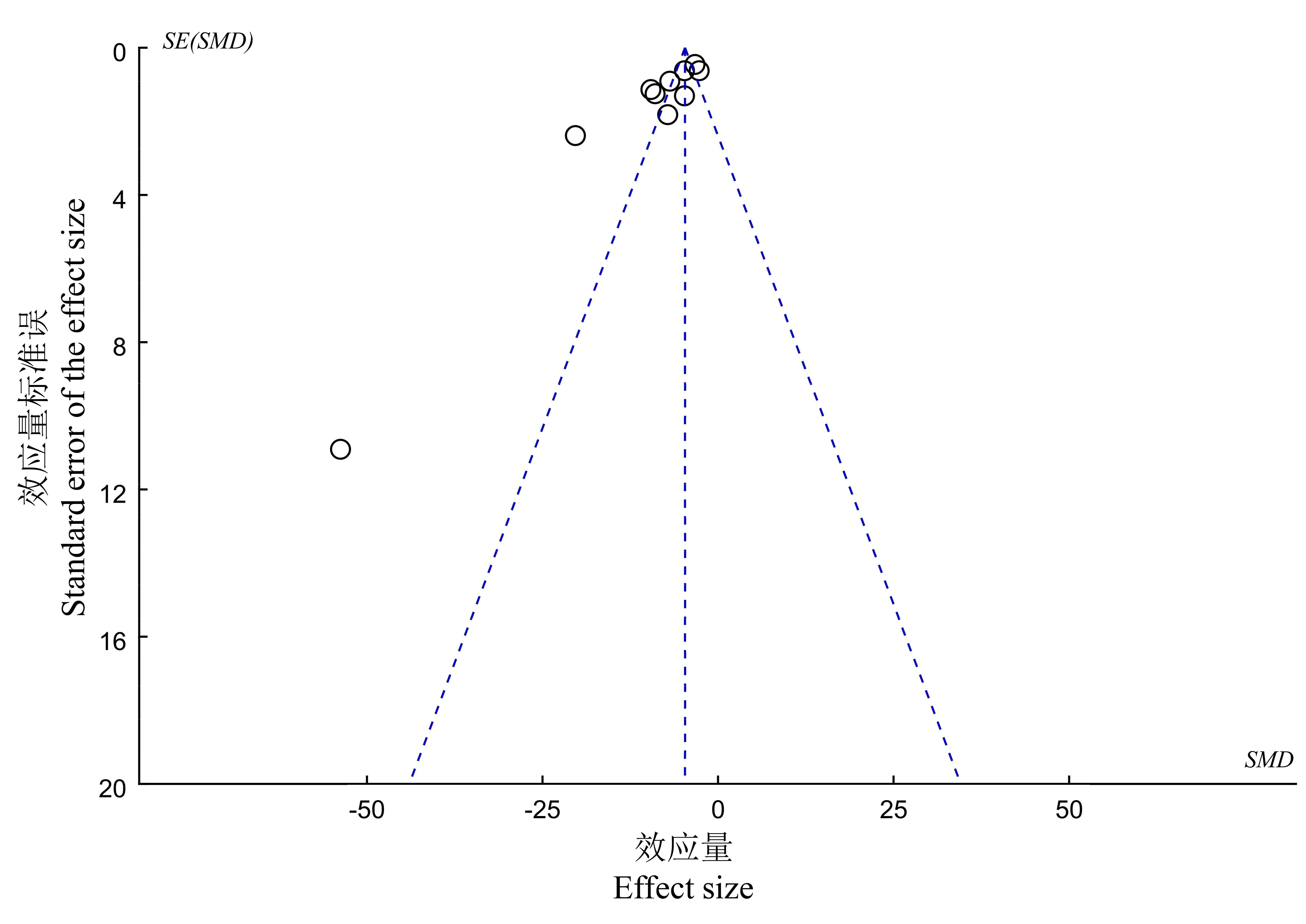
图7 黄芪成分影响血清淀粉酶的漏斗图注:标准化均数差(SMD);标准误(SE)。
Figure 7 Funnel plot of effects of Astragali Radix ingredients on AMSNote:Standardized mean difference (SMD), Standard error (SE).
| [1] | MEDEROS M A, REBER H A, GIRGIS M D. Acute pancreatitis: a review[J]. JAMA, 2021, 325(4):382-390. DOI:10.1001/jama.2020.20317 . |
| [2] | SCHEPERS N J, BAKKER O J, BESSELINK M G, et al. Impact of characteristics of organ failure and infected necrosis on mortality in necrotising pancreatitis[J]. Gut, 2019, 68(6):1044-1051. DOI:10.1136/gutjnl-2017-314657 . |
| [3] | HAN K, CHEN S M, SONG Y, et al. Burden of pancreatitis and associated risk factors in China, 1990 to 2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Chin Med J (Engl), 2022, 135(11):1340-1347. DOI:10.1097/CM9.0000000000002164 . |
| [4] | GARDNER T B. Acute pancreatitis[J]. Ann Intern Med, 2021, 174(2): ITC17-ITC32. DOI:10.7326/aitc202102160 . |
| [5] | 李芝萍, 汪娅君, 张菊萍, 等. 通腑逐瘀方联合常规西药治疗腑实热结证急性胰腺炎临床研究[J]. 新中医, 2024, 56(10):81-85. DOI: 10.13457/j.cnki.jncm.2024.10.016 . |
| LI Z P, WANG Y J, ZHANG J P, et al. Clinical study on Tongfu Zhuyu decoction combined with conventional western medicine for acute pancreatitis with syndrome of bowel excess and heat bind[J]. New Chin Med, 2024, 56(10):81-85. DOI: 10.13457/j.cnki.jncm.2024.10.016 . | |
| [6] | BOXHOORN L, VOERMANS R P, BOUWENSE S A, et al. Acute pancreatitis[J]. Lancet, 2020, 396(10252):726-734. DOI:10.1016/s0140-6736(20)31310-6 . |
| [7] | WANG P P, WANG Z, ZHANG Z P, et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus[J]. Front Pharmacol, 2023, 14:1242318. DOI:10.3389/fphar.2023.1242318 . |
| [8] | 张琪, 张会芳, 李兆洋, 等. 黄芪注射液对急性胰腺炎患者氧化应激状态及肠黏膜屏障功能的影响[J]. 吉林中医药, 2021, 41(12):1616-1619. DOI: 10.13463/j.cnki.jlzyy.2021.12.021 . |
| ZHANG Q, ZHANG H F, LI Z Y, et al. Effects of Huangqi Injection on the oxidative stress and intestinal mucosal barrier function in patients with acute pancreatitis[J]. Jilin J Chin Med, 2021, 41(12):1616-1619. DOI: 10.13463/j.cnki.jlzyy.2021.12.021 . | |
| [9] | 王嫄嫄, 郑洋, 周哲, 等. 黄芪注射液对急性胰腺炎肠道屏障功能和微炎性反应状态的影响[J]. 世界中医药, 2018, 13(4):818-821. DOI: 10.3969/j.issn.1673-7202.2018.04.008 . |
| WANG Y Y, ZHENG Y, ZHOU Z, et al. Clinical study on Huangqi injection on intestinal barrier function and micro inflammatory state in patients with acute pancreatitis[J]. World Chin Med, 2018, 13(4):818-821. DOI: 10.3969/j.issn.1673-7202.2018.04.008 . | |
| [10] | AL-MASAWA M E, ALSHAWSH M A, NG C Y, et al. Efficacy and safety of small extracellular vesicle interventions in wound healing and skin regeneration: a systematic review and meta-analysis of animal studies[J]. Theranostics, 2022, 12(15):6455-6508. DOI:10.7150/thno.73436 . |
| [11] | LIU D S, SONG D X, NING W H, et al. Efficacy and safety of prophylaxis for venous thromboembolism in brain neoplasm patients undergoing neurosurgery: a systematic review and Bayesian network meta-analysis[J]. J Thromb Thrombolysis, 2023, 55(4):710-720. DOI:10.1007/s11239-023-02780-3 . |
| [12] | 孙海燕, 黄民, 关溯. 黄芪总苷对实验性急性胰腺炎的保护作用[J]. 时珍国医国药, 2006, 17(10):1980-1981. DOI: 10.3969/j.issn.1008-0805.2006.10.044 . |
| SUN H Y, HUANG M, GUAN S. Effects of astragalosides on experimental acute pancreatitis[J]. Lishizhen Med Mater Med Res, 2006(10):1980-1981. DOI: 10.3969/j.issn.1008-0805.2006.10.044 . | |
| [13] | 傅强, 崔乃强, 邵伟, 等. 急性出血坏死性胰腺炎小鼠辅助性T细胞亚群1/2的变化规律及中药干预作用研究[J]. 中国中西医结合急救杂志, 2006, 13(4):214-217. DOI: 10.3321/j.issn: 1008-9691.2006.04.006 . |
| FU Q, CUI N Q, SHAO W, et al. Study on regularity of changes of helper T cell subgroup Th1/Th2 and interference effect of traditional Chinese medicine in mice with acute hemorrhage necrotizing pancreatitis[J]. Chin J Integr Tradit West Med Intensive Crit Care, 2006, 13(4):214-217. DOI: 10.3321/j.issn: 1008-9691.2006.04.006 . | |
| [14] | 郭文学. 重症急性胰腺炎时MDA、SOD与肝脏微循环变化及黄芪干预的实验研究[D]. 石家庄: 河北医科大学, 2008. DOI: 10.7666/d.y1353969 . |
| GUO W X. Severe acute pancreatitis MDA, SOD and liver microcirculation changes and the experimental intervention study of Astragalus[D]. Shijiazhaung: Hebei Medical University, 2008. DOI: 10.7666/d.y1353969 . | |
| [15] | 朱渊红, 王真, 蔡宛如. 黄芪注射液对SAP肺损伤大鼠的实验研究[J]. 中华中医药学刊, 2009, 27(12):2608-2609. DOI: 10.13193/j.archtcm.2009.12.146.zhuyh.041 . |
| ZHU Y H, WANG Z, CAI W R. The experimental study on Astragalus to rats with lung injury associated with severe acute pancreatitis[J]. Chin Arch Tradit Chin Med, 2009, 27(12):2608-2609. DOI: 10.13193/j.archtcm.2009.12.146.zhuyh.041 . | |
| [16] | 朱渊红, 王新华, 陈芝芸. 黄芪注射液对SAP肺损伤大鼠SOD、MDA及肺组织bcl-2、bax蛋白表达的影响[J]. 中国中医药科技, 2012, 19(5):416-417, 441. DOI: 10.3969/j.issn.1005-7072.2012.05.022 . |
| ZHU Y H, WANG X H, CHEN Z Y. Effects of Astragalus injection on SOD, MDA and the expression of bcl-2 and bax protein in lung tissue of rats with SAP lung injury[J]. Chin J Tradit Med Sci Technol, 2012, 19(5):416-417, 441. DOI: 10.3969/j.issn.1005-7072.2012.05.022 . | |
| [17] | 邱雷, 史建华, 殷国建, 等. 黄芪甲苷对实验性大鼠重症急性胰腺炎的治疗作用[J]. 上海医学, 2014, 37(3):227-230, 178. DOI: CNKI:SUN:SHYX.0.2014-03-020.QIU L , |
| WANG S Y, CHU W W, HUO Y, et al. Effect of Huangqi injection on oxidative relevant materials of peripheral serum in rats with severe acute pancreatitis[J]. Med Pharm J Chin People's Liberation Army, 2014, 26(12):5-7. DOI: 10.3969/j.issn.2095-140X.2014.12.002 . | |
| [18] | SHI J H, YIN G J, et al. Therapeutic effects of astragaloside Ⅳ on severe acute pancreatitis in rats[J]. Shanghai Med J, 2014, 37(3):227-230, 178. DOI: CNKI:SUN:SHYX.0.2014-03-020 . |
| 王少言, 初巍巍, 霍阳, 等. 黄芪注射液对重症急性胰腺炎大鼠外 周血清氧化相关物质的影响[J]. 解放军医药杂志, 2014, 26(12):5- 7. DOI: 10.3969/j.issn.2095-140X.2014.12.002 . | |
| [19] | QIU L, YIN G J, CHENG L, et al. Astragaloside IV ameliorates acute pancreatitis in rats by inhibiting the activation of nuclear factor-κB[J]. Int J Mol Med, 2015, 35(3):625-636. DOI:10.3892/ijmm.2015.2070 . |
| [20] | 王秉钧, 王先坤, 晏波, 等. 黄芪多糖对大鼠重症急性胰腺炎的作用及机制[J]. 中国医院药学杂志, 2016, 36(16):1366-1368. DOI: 10.13286/j.cnki.chinhosppharmacyj.2016.16.08 . |
| WANG B J, WANG X K, YAN B, et al. Effects of Astragalus polysaccharides on rats with severe acute pancreatitis and underlying mechanisms[J]. Chin J Hosp Pharm, 2016, 36(16):1366-1368. DOI: 10.13286/j.cnki.chinhosppharmacyj.2016.16.08 . | |
| [21] | 郑洋, 于晶晶, 杜鹃, 等. 黄芪注射液对急性胰腺炎大鼠肠道屏障功能的影响[J]. 中国临床研究, 2016, 29(12):1614-1617. DOI: 10.13429/j.cnki.cjcr.2016.12.006 . |
| ZHENG Y, YU J J, DU J, et al. Effects of Astragalus injection on intestinal barrier functions in rats with acute pancreatitis[J]. Chin J Clin Res, 2016, 29(12):1614-1617. DOI: 10.13429/j.cnki.cjcr.2016.12.006 . | |
| [22] | 邓蓓蓓. 黄芪多糖对重症急性胰腺炎大鼠肠粘膜屏障损伤的保护作用[D]. 长春: 吉林大学, 2017. DOI: CNKI:CDMD:2.1017.148739 . |
| ZHENG B B. Protection of astragalus polysacharin on intestinal barrier dysfunction in rats with severe acute pancreatitis[D]. Changchun: Jilin University, 2017. DOI: CNKI:CDMD:2.1017.148739 . | |
| [23] | MA R, YUAN F, WANG S X, et al. Calycosin alleviates cerulein-induced acute pancreatitis by inhibiting the inflammatory response and oxidative stress via the p38 MAPK and NF-κB signal pathways in mice[J]. Biomed Pharmacother, 2018, 105:599-605. DOI:10.1016/j.biopha.2018.05.080 . |
| [24] | 吴爱祥. 黄芪甲苷对重症急性胰腺炎小鼠胰腺的影响[J]. 中国临床药理学杂志, 2019, 35(18):2065-2067. DOI: 10.13699/j.cnki.1001-6821.2019.18.028 . |
| WU A X. Effects of Astragalus glycoside in severe acute pancreatitis mice[J]. Chin J Clin Pharmacol, 2019, 35(18):2065-2067. DOI: 10.13699/j.cnki.1001-6821.2019.18.028 . | |
| [25] | ZHU C J, YANG W G, LI D J, et al. Calycosin attenuates severe acute pancreatitis-associated acute lung injury by curtailing high mobility group box 1 - induced inflammation[J]. World J Gastroenterol, 2021, 27(44):7669-7686. DOI:10.3748/wjg.v27.i44.7669 . |
| [26] | 金玲玲, 汤斌斌, 周晶晶, 等. 黄芪总皂苷对重症急性胰腺炎大鼠肠道损伤的保护作用及对肠组织p38MAPK/NF-κB表达的影响[J]. 新中医, 2021, 53(7):6-10. DOI: 10.13457/j.cnki.jncm.2021.07.002 . |
| JIN L L, TANG B B, ZHOU J J, et al. Total saponins of Astragalus has protective effect on intestinal injury in rats with severe acute pancreatitis and its effect on P38MAPK/NF-κB expressions in intestinal tissues[J]. J New Chin Med, 2021, 53(7):6-10. DOI: 10.13457/j.cnki.jncm.2021.07.002 . | |
| [27] | 王欣, 周文勇, 孙月. 黄芪总皂苷通过激活Nrf2/HO-1信号通路缓解L-精氨酸诱导的小鼠急性胰腺炎氧化损伤的研究[J]. 现代中药研究与实践, 2022, 36(3):38-42. DOI: 10.13728/j.1673-6427.2022.03.008 . |
| WANG X, ZHOU W Y, SUN Y. Study on the effect of Astragalus saponins on oxidative damage of L-arginine induced acute pancreatitis in mice by activating Nrf2/HO-1 signaling pathway[J]. Res Pract Chin Med, 2022, 36(3):38-42. DOI: 10.13728/j.1673-6427.2022.03.008 . | |
| [28] | 洪春霞, 张照伟, 陈伟前. 黄芪注射液通过调控mTOR/p70S6K信号通路对急性出血坏死型胰腺炎肺损伤炎症反应的影响[J]. 世界华人消化杂志, 2023, 31(5): 184-192. DOI: 10.11569/wcjd.v31.i5.184 . |
| HONG C X, ZHANG Z W, CHEN W Q. Astragalus injection improves inflammatory response in lung injury in acute hemorrhagic necrotizing pancreatitis by regulating the mTOR/p70S6K signal pathway[J]. World Chin J Digestol, 2023, 31(5): 184-192. DOI: 10.11569/wcjd.v31.i5.184 . | |
| [29] | 李振国, 孔德生, 李文科. 黄芪多糖对大鼠急性胰腺炎的作用及其机制研究[J]. 海南医学, 2024, 35(1):6-9. DOI: 10.3969/j.issn.1003-6350.2024.01.002 . |
| LI Z G, KONG D S, LI W K. Effect of Astragalus polysaccharides on acute pancreatitis in rats and its mechanism[J]. Hainan Med J, 2024, 35(1):6-9. DOI: 10.3969/j.issn.1003-6350.2024.01.002 . | |
| [30] | HOU X T, YU M, XU Y, et al. Antioxidative effect of astragalosides on acute pancreatitis in mice[J]. Front Vet Sci, 2024, 11:1418899. DOI:10.3389/fvets.2024.1418899 . |
| [31] | PEERY AF, CROCKETT SD, MURPHY CC, et al. Burden and Cost of Gastrointestinal, Liver, and Pancreatic Diseases in the United States: Update 2018. Gastroenterology. 2019, 156(1):254-272.e11. DOI: 10.1053/j.gastro.2018.08.063 . |
| [32] | 尉洪利, 单连美, 孙玉欣, 等. 柴胡龙骨牡蛎汤对肝胆湿热证急性胰腺炎患者的临床疗效[J]. 中成药, 2025, 47(1):338-341. DOI: 10.3969/j.issn.100-1528.2025.01.056 . |
| YU H L, SHAN L M, SUN Y X, et al. Clinical effect of Chaihu Longgu Muli decoction on acute pancreatitis with hepatobiliary damp-heat syndrome[J]. Chin Tradit Pat Med, 2025, 47(1):338-341. DOI: 10.3969/j.issn.100-1528.2025.01.056 . | |
| [33] | 林杉, 秦文昊, 代崧霖, 等. 中药辅助治疗经内镜逆行胰胆管造影术后急性胰腺炎研究进展[J]. 中国中西医结合杂志, 2024, 44(11):1400-1404. DOI: 10.7661/j.cjim.20240910.272 . |
| LIN S, QIN W H, DAI S L, et al. Research progress on traditional Chinese medicine assisted treatment of acute pancreatitis after endoscopic retrograde cholangiopancreatography[J]. Chin J Integr Tradit West Med, 2024, 44(11):1400-1404. DOI: 10.7661/j.cjim.20240910.272 . | |
| [34] | 谢红英, 罗晓丽, 卢慧. 黄芪注射液对病毒性心肌炎患者外周血NLRP3炎性小体表达的影响[J]. 西部中医药, 2021, 34(7):94-97. DOI: 10.12174/j.issn.2096-9600.2021.07.24 . |
| XIE H Y, LUO X L, LU H. Influence of Huangqi injection on the expressions of NLRP3 inflammasome in peripheral blood of patients with viral myocarditis[J]. West J Tradit Chin Med, 2021, 34(7):94-97. DOI: 10.12174/j.issn.2096-9600.2021.07.24 . | |
| [35] | 张燕. 黄芪注射液联合布地奈德对支气管哮喘急性发作患者肺功能的影响[J]. 实用中西医结合临床, 2021, 21(17):71-72. DOI: 10.13638/j.issn.1671-4040.2021.17.033 . |
| ZHANG Y. Effect of Astragalus injection combined with budesonide on lung function in patients with acute attack of bronchial asthma[J]. Pract Clin J Integr Tradit Chin West Med, 2021, 21(17):71-72. DOI: 10.13638/j.issn.1671-4040.2021.17.033 . | |
| [36] | 中华医学会外科学分会胰腺外科学组. 中国急性胰腺炎诊治指南(2021)[J]. 浙江实用医学, 2021, 26(6):511-519, 535. DOI: 10.16794/j.cnki.cn33-1207/r.2021.06.003 . |
| Study Group Of Pancreatic Surgery In China Society Of Surgery Of Chinese Medical Association. Guidelines for diagnosis and treatment of acute pancreatitis in China(2021)[J]. Zhejiang Pract Med, 2021, 26(6):511-519, 535. DOI: 10.16794/j.cnki.cn33-1207/r.2021.06.003 . | |
| [37] | LEPPÄNIEMI A, TOLONEN M, TARASCONI A, et al. 2019 WSES guidelines for the management of severe acute pancreatitis[J]. World J Emerg Surg, 2019, 14:27. DOI:10.1186/s13017-019-0247-0 . |
| [38] | 宋艳, 何永恒, 杨芳, 等. 黄芪多糖调节脂联素/TLR/NF-κB信号通路对溃疡性结肠炎小鼠的治疗作用[J]. 中国免疫学杂志, 2021, 37(11):1319-1324. DOI: 10.3969/j.issn.1000-484X.2021.11.008 . |
| SONG Y, HE Y H, YANG F, et al. Regulatory effect of Astragalus polysaccharide on adiponectin/TLR/NF-κB signal pathway in mice with ulcerative colitis[J]. Chin J Immunol, 2021, 37(11):1319-1324. DOI: 10.3969/j.issn.1000-484X.2021.11.008 . | |
| [39] | HABTEZION A, GUKOVSKAYA A S, PANDOL S J. Acute pancreatitis: a multifaceted set of organelle and cellular interactions[J]. Gastroenterology, 2019, 156(7):1941-1950. DOI:10.1053/j.gastro.2018.11.082 . |
| [40] | LIU D L, WEN L L, WANG Z D, et al. The mechanism of lung and intestinal injury in acute pancreatitis: a review[J]. Front Med, 2022, 9:904078. DOI:10.3389/fmed.2022.904078 . |
| [41] | JIAO J Y, LIU J J, LUO F, et al. Qingyi granules ameliorate severe acute pancreatitis in rats by modulating the gut microbiota and serum metabolic aberrations[J]. Pharm Biol, 2023, 61(1):927-937. DOI:10.1080/13880209.2023.2222755 . |
| [42] | WANG L J, JIN Y L, PEI W L, et al. Amuc_1100 pretreatment alleviates acute pancreatitis in a mouse model through regulating gut microbiota and inhibiting inflammatory infiltration[J]. Acta Pharmacol Sin, 2024, 45(3):570-580. DOI:10.1038/s41401-023-01186-4 . |
| [43] | PALATHINGAL BAVA E, GEORGE J, TARIQUE M, et al. Pirfenidone increases IL-10 and improves acute pancreatitis in multiple clinically relevant murine models[J]. JCI Insight, 2022, 7(2): e141108. DOI:10.1172/jci.insight.141108 . |
| [44] | LI H Y, WU D, ZHANG H D, et al. Autophagy-mediated ferroptosis is involved in development of severe acute pancreatitis[J]. BMC Gastroenterol, 2024, 24(1):245. DOI:10.1186/s12876-024-03345-1 . |
| [45] | 周龙云, 田子睿, 刘书芬, 等. 黄芪对中枢神经系统的药理作用及毒理研究现状[J]. 中草药, 2018, 49(20):4935-4944. DOI: 10.7501/j.issn.0253-2670.2018.20.034 . |
| ZHOU L Y, TIAN Z R, LIU S F, et al. Review on neuroprotection effect of Astragali Radix on central nervous system and related toxicology[J]. Chin Tradit Herb Drugs, 2018, 49(20):4935-4944. DOI: 10.7501/j.issn.0253-2670.2018.20.034 . |
| [1] | 贡磊磊, 王晓霞, 封学伟, 李心蕾, 赵涵, 张雪艳, 冯欣. 不同浓度环磷酰胺诱导早发性卵巢功能不全小鼠模型及作用机制研究[J]. 实验动物与比较医学, 2025, 45(4): 403-410. |
| [2] | 姜娟, 宋宁, 连文博, 邵丛丛, 顾文文, 石燕. 两种浓度乙醇溶液灌注建立小鼠宫腔粘连模型的组织病理和分子病理表型比较[J]. 实验动物与比较医学, 2025, 45(4): 393-402. |
| [3] | 刘月琴, 薛卫国, 王淑友, 申耀华, 贾术永, 王广军, 宋晓晶. 探头式激光共聚焦成像技术用于小鼠消化道组织形态特征分析[J]. 实验动物与比较医学, 2025, 45(4): 457-465. |
| [4] | 郑卿勇, 杨冬华, 马智超, 周姿余, 陆洋, 王晶宇, 邢丽娜, 康迎英, 杜莉, 赵春香, 狄宝山, 田金徽. 动物实验系统评价与Meta分析报告的规范撰写建议[J]. 实验动物与比较医学, 2025, 45(4): 496-507. |
| [5] | 秦超, 李双星, 赵婷婷, 蒋晨晨, 赵晶, 杨艳伟, 林志, 王三龙, 文海若. 药物安全评价用SD大鼠90 d喂养试验的背景数据研究[J]. 实验动物与比较医学, 2025, 45(4): 439-448. |
| [6] | 刘力瑜, 嵇波, 刘小玄, 方洋, 张玲, 郭亭廷, 全烨, 李鹤文, 刘翼天. 大鼠胎儿期肺组织固定方法的探索[J]. 实验动物与比较医学, 2025, 45(4): 432-438. |
| [7] | 肖林林, 杨逸萱, 黎珊杉, 罗兰诗雨, 尹思威, 孙俊铭, 施维, 欧阳轶强, 李习艺. 利用脑立体定位技术将人源三突变APP基因导入海马区构建阿尔茨海默病大鼠模型[J]. 实验动物与比较医学, 2025, 45(3): 269-278. |
| [8] | 罗莲莲, 袁艳春, 王俊岭, 时广森. 肌萎缩侧索硬化症小鼠模型研究进展[J]. 实验动物与比较医学, 2025, 45(3): 290-299. |
| [9] | 姜萌, 郝淑兰, 仝立国, 仲启明, 高振飞, 王永辉, 王晞星, 吉海杰. 长春瑞滨诱导大鼠足背静脉炎模型的动态评价[J]. 实验动物与比较医学, 2025, 45(3): 251-258. |
| [10] | 孔志豪, 魏晓锋, 于灵芝, 冯丽萍, 朱琦, 施国君, 王晨. 鳞状皮屑裸小鼠木糖葡萄球菌的分离鉴定[J]. 实验动物与比较医学, 2025, 45(3): 368-375. |
| [11] | 潘颐聪, 蒋汶洪, 胡明, 覃晓. 慢性肾脏病大鼠主动脉钙化模型的术式优化及效果评价[J]. 实验动物与比较医学, 2025, 45(3): 279-289. |
| [12] | 刘智伟, 杨然, 连浩, 张玉, 金立伦. 秦皮素对碘乙酸钠诱导骨关节炎模型大鼠的软骨保护与抗炎作用[J]. 实验动物与比较医学, 2025, 45(3): 259-268. |
| [13] | 许秋雨, 严国锋, 付丽, 范文华, 周晶, 朱莲, 仇淑雯, 张洁, 吴铃. 来曲唑缓释片皮下给药构建小鼠多囊卵巢综合征模型及其肝脏转录组学分析[J]. 实验动物与比较医学, 2025, 45(2): 119-129. |
| [14] | 潘钱家, 葛峻沂, 胡楠, 华飞, 顾敏. 基于16S rRNA测序的2型糖尿病db/db小鼠模型口腔菌群差异分析[J]. 实验动物与比较医学, 2025, 45(2): 147-157. |
| [15] | 闵凡贵, 富宏坤, 刘永刚, 刘香梅, 刘忠华, 李垚, 陶雨风. 感染性动物实验的福利与伦理特殊要求[J]. 实验动物与比较医学, 2025, 45(2): 239-246. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||