阿尔茨海默病(Alzheimer's disease, AD)是一种神经退行性疾病[1-3],在全球范围内发病率及死亡率均呈上升趋势,且发病年龄呈年轻化趋势。据《2024年中国阿尔茨海默病报告》统计,我国的AD及其他痴呆导致死亡、患病及伤残调整生命年等相关标化指标均高于全球水平,提示我国在应对AD这一公共卫生挑战上面临严峻考验[1]。AD的病理特征包括β-淀粉样蛋白(amyloid β-protein, Aβ)沉积、Tau蛋白过度磷酸化形成的神经纤维缠结、神经元丢失以及突触损伤。在AD的发病机制研究中, Aβ级联假说被公认是经典学说之一[4-5],即淀粉样前体蛋白(amyloid precursor protein,APP)代谢异常,不仅导致β分泌酶切割途径激活,同时改变γ分泌酶切割位点偏好性,使APP剪切过程中产生更多毒性Aβ沉积,进而触发神经元损伤、突触功能障碍及脑区特异性神经元死亡。研究表明,APP基因突变可通过增强β分泌酶切割效率或促进Aβ1-42生成显著加速淀粉样斑块沉积[6-7]。常见的APP突变类型有Swedish、London和Austrian突变[8-9],其是家族性AD的重要诱因[10]。精准模拟APP异常代谢的动物模型对解析AD病理机制及药物研发至关重要。使用人源性的突变APP导入实验动物脑海马区可以构建模拟遗传突变类型的AD模型。
啮齿类实验动物小鼠常用于AD转基因模型[11-12]。与小鼠相比,大鼠在认知、行为、大脑结构及药物代谢上更接近人类[13-14],且寿命长、体型大,便于操作与采样,更适合构建AD模型。近年来,基于病毒载体的基因递送技术为AD模型构建提供了新策略。腺相关病毒(adeno-associated virus,AAV)凭借其高转导效率、低免疫原性、跨血脑屏障能力及精准的脑区靶向性[15],成为神经科学研究中理想的基因递送工具。本研究拟通过脑立体定位注射携带人源三突变(Swedish/London/Austrian)APP基因的AAV载体,构建AD大鼠模型,以期更真实地模拟Aβ异常沉积的病理进程,为深入探究AD发病机制和药物开发提供研究基础。
1 材料与方法
1.1 实验动物
24只SPF级雌性SD大鼠均12周龄,体重为(250±20)g,购自广西医科大学实验动物中心[SCXK(桂)2020-0003]。动物饲养于广西医科大学实验动物中心的动物实验室屏障系统[SYXK(桂)2020-0004],相对湿度50%~60%,温度22~24 ℃,大鼠可自由饮水和进食。本实验方案通过广西医科大学实验动物伦理委员会的伦理审查(编号为202404010)。所有动物实验操作遵循实验动物伦理福利3R原则。
1.2 主要试剂与仪器
重组腺相关病毒(recombinant adeno-associated virus,rAAV)-APPs1a-Nluc和rAAV-Nluc购自武汉枢密脑科学技术有限公司,均为定制产品;RNA提取试剂盒(批号S20205)、RNA反转录试剂盒(批号R31107)、实时荧光定量PCR试剂盒(批号R10101)均购自北京全式金生物技术股份有限公司;活体成像萤光素酶底物Furimazine(批号162434)购自上海陶素生物科技有限公司;即用型免疫组化SP试剂盒(批号246289710D)购自福州迈新生物技术开发有限公司;Aβ蛋白抗体(批号B430350)购自美国BioLegend公司。
小动物活体成像仪购自美国PerkinElmer公司;SMART 3.0小动物行为学记录分析系统、旷场箱、大鼠新物体识别实验玩具、双通道小动物麻醉机、大鼠脑立体定位气麻呼吸面罩和异氟烷(批号20211520)均购自深圳市瑞沃德生命科技有限公司;荧光定量PCR仪(型号QuantStudio 7 Flex)购自美国Thermo Fisher公司;石蜡包埋与切片机(型号RM2235)和生物显微镜(型号BX53)均购自德国Leica公司。
1.3 重组腺相关病毒载体的构建
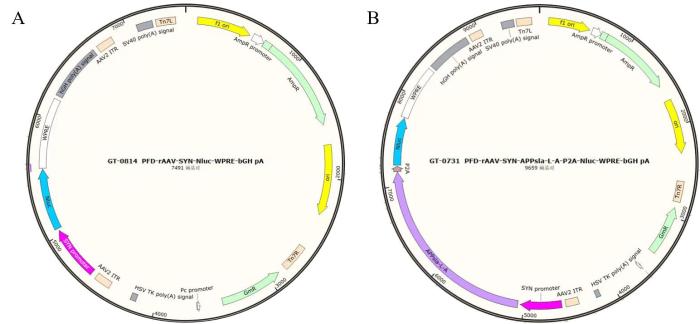
采用rAAV载体构建技术[16],构建携带人源三突变APP基因的rAAV载体。以携带NanoLuc萤光素酶基因的AAV质粒为骨架载体,整合AAV2血清型的反向末端重复序列(inverted terminal repeats,ITRs)作为病毒基因组复制与包装的顺式作用元件,用在辅助质粒上单独表达的AAV9血清型衣壳蛋白基因(Cap)构建病毒外壳,在NanoLuc萤光素酶基因前插入含Swedish(K670N/M671L)、London(V717I)及Austrian(T714I)三重突变的APP cDNA序列,构建实验组病毒载体质粒。空载病毒质粒不携带人源APP cDNA序列。
空载病毒以及目的病毒的载体结构如图1所示。目的载体携带人源三突变APP基因以及NanoLuc萤光素酶基因,两个基因共用一个启动子,NanoLuc萤光素酶基因位于APP基因之后,若萤光素酶基因成功表达则可推测位于前面的APP基因也成功表达对应蛋白。两者间用P2A肽隔开,使两个蛋白独立表达,以免影响蛋白后续修饰。空载病毒和目的病毒相比,除了缺少人源三突变APP基因外,其他部分皆相同。
图1
图1
重组腺相关病毒载体结构示意图
Figure 1
Schematic diagram of recombinant adeno-associated viral vector structure
1.4 动物分组及脑立体定位接种造模
将24只SD大鼠随机分为空白对照组(blank control group,BC)、空载病毒组(virus control group,VC)以及实验组(experimental group,Exp),每组8只。空白对照组不做处理,空载病毒组注射AAV空载体(rAAV-Nluc),实验组大鼠注射携带人源三突变APP基因的AAV(rAAV-APPs1a-Nluc)载体质粒。
将大鼠置于气体麻醉诱导盒内用异氟烷麻醉后,剃去大鼠头部区域毛发,用75%乙醇溶液对皮肤进行消毒,以脑立体定位气麻呼吸面罩维持麻醉,并固定于脑立体定位仪上,暴露大鼠颅骨上的前囟点和后囟点并调节仪器参数:脑立体定位注射位置为正中矢状缝左右旁开2 mm,前囟后3.3 mm,硬脑膜下进针深度3 mm,坐标(±2,-3.3,-3)。使用牙科钻钻至硬脑膜表面后,用5 μL规格的无菌微量注射器进行病毒注射,双侧脑区各注射2 μL 1×1013 vg/mL的病毒悬液。注射完成后用骨蜡填充注射孔,缝合头皮,碘伏消毒后放回笼中饲养。
病毒注射后2周及6个月时,称量各组大鼠体重,按照每100 g体重腹腔注射5 mmol/L的萤光素酶底物Furimazine 0.23 mL,注射10~15 min后,将大鼠进行异氟烷气体麻醉,待动物失去知觉后,立刻放入活体成像仪中维持麻醉,调整参数进行生物发光拍照和记录结果。
1.5 新物体识别实验检测大鼠的认知记忆能力
注射病毒6个月后进行各组大鼠的新物体识别实验,具体操作如下:将大鼠放入旷场箱熟悉5 min,将两个完全相同的圆柱体放入旷场箱一侧靠边缘位置;将大鼠再次放入旷场箱中,让其探索10 min,记录大鼠与物体的互动情况;1 h后,将其中一个圆柱体替换为不同颜色的圆锥体,再次将大鼠放入旷场箱中,让其探索10 min,记录大鼠对新旧物体的探索时间、次数等。每次测试结束后,将大鼠放回饲养笼,清洁旷场箱以消除气味。由行为学分析系统识别动物运动轨迹,得出探索时间,然后通过计算新物体识别指数(recognition index,RI)来判断大鼠的学习记忆能力。RI时间值=探索新物体时间/(探索新物体时间+探索旧物体时间),RI距离值=探索新物体距离/(探索新物体距离+探索旧物体距离)。
1.6 荧光定量PCR检测大鼠脑海马区APP基因表达
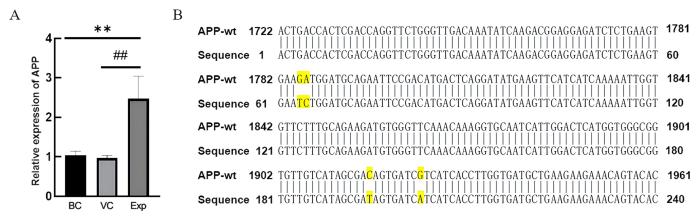
行为学实验后,每组随机取4只大鼠,称量其体重,按50 mg/kg的剂量腹腔注射戊巴比妥钠溶液麻醉大鼠,颈椎脱臼处死大鼠。剥离脑组织,摘取海马体,液氮速冻后置于-80 ℃冰箱保存。根据人类三突变APP基因和大鼠APP基因的保守区域序列(来源于NCBI网站)设计引物,可同时扩增2种基因,上游引物为5’-ACTGACCACTCGACCAGGTTC-3’,下游引物为5’-GGCGTCAACCTCCACCACA-3’。内参基因β-actin的上游引物为5’-TGTCACCAACTGGG-ACGATA-3’,下游引物为5’-GGGGTGTTGAAGGTC-TCAAA-3’。按照试剂盒说明书步骤提取RNA,并逆转录,对APP基因进行实时荧光定量PCR扩增,反应程序:94 ℃ 30 s预变性;94 ℃ 5 s,60 ℃ 30 s,循环扩增40次。反应结束后导出Ct值等数据,运用2-ΔΔCt法计算相对表达量,并进行统计学分析。同时,对实时荧光定量PCR扩增产物采用测通法测序验证。PCR引物合成及扩增产物测序均由生工生物工程(上海)股份有限公司完成。
1.7 海马区脑组织病理学检测
每组取另外3只大鼠用于组织病理学检测(剩余1只为备用)。大鼠麻醉后用生理盐水灌注心脏以置换血液,再用4%多聚甲醛溶液灌注后剥离脑组织。将脑组织浸泡于4%多聚甲醛溶液固定48 h后,用梯度乙醇溶液常规脱水、二甲苯透明后浸蜡包埋,石蜡切片4 μm。分别采用HE染色法、尼氏染色法、免疫组织化学法检测大鼠海马区脑组织的常规组织病理特征、神经元变化以及Aβ沉积情况。
HE染色:石蜡切片脱蜡后先用苏木精染色细胞核,分化后再用伊红染液染色;倾去多余染色液后快速脱水,二甲苯透明,中性树胶封固。
尼氏染色:石蜡切片脱蜡后,用尼氏染色液浸染10 min;自来水洗去多余染液,用尼氏分化液分化30 s,终止分化。显微镜下初步观察染色情况,显色清晰即可用乙醇溶液梯度脱水,二甲苯透明,中性树胶封固。
免疫组织化学染色:石蜡切片常规脱蜡,EDTA热修复后,进行内源性过氧化物酶阻断和血清封闭;加入Aβ单克隆抗体4 ℃过夜孵育,漂洗后再加入生物素标记的山羊抗鼠/兔二抗于室温孵育30 min,DAB显色后加入苏木精对比染色细胞核;显微镜下初步观察,染色正常则脱水封固,然后在光学显微镜下进行观察和拍照。
1.8 统计学分析
采用SPSS 22.0软件对各实验结果数据进行分析处理。符合正态分布且方差齐性的各组数据采用单因素方差分析,组内两两比较采用LSD-t检验;不符合正态分布和方差齐性要求的数据用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模后重组AAV在大鼠脑部有效表达
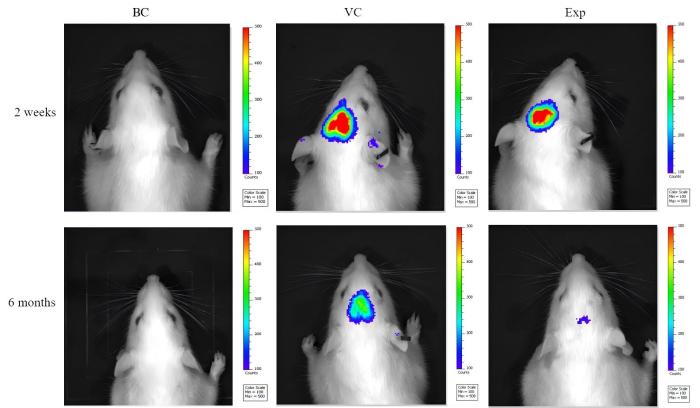
造模2周后,腹腔注射萤光素酶底物Furimazine进行各组大鼠活体成像(图2),结果显示,实验组与空载病毒组大鼠头部区域可检测到荧光发光,空白对照组大鼠未检测到荧光;造模6个月后实验组和空载病毒组的荧光强度都减弱,但仍然可以被检测到。结果证明造模后大鼠脑部有效表达rAAV。
图2
图2
注射病毒2周和6个月后大鼠活体成像情况
Figure 2
In vivo imaging of rats two weeks and six months after virus injection
2.2 造模后大鼠的认知记忆能力降低
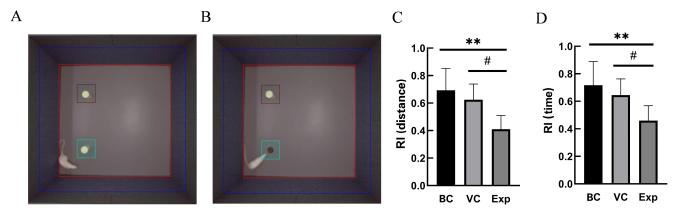
rAAV感染后,受试大鼠的新物体识别实验结果(图3)表明,实验组的距离认知指数和时间指数均明显低于空白对照组(P<0.01)和空载体病毒组(P<0.05),而空白对照组与空载病毒组相比差异无统计学意义(P>0.05)。结果提示造模后大鼠的认知记忆能力明显下降。
图3
图3
新物体识别实验检测大鼠认知记忆能力
Figure 3
Novel object recognition test to assess recognition memory of rats
2.3 造模后大鼠海马体中APP基因表达增强
图4
图4
大鼠海马体APP 基因表达及测序结果
Figure 4
APP gene expression and sequencing results in rat hippocampus
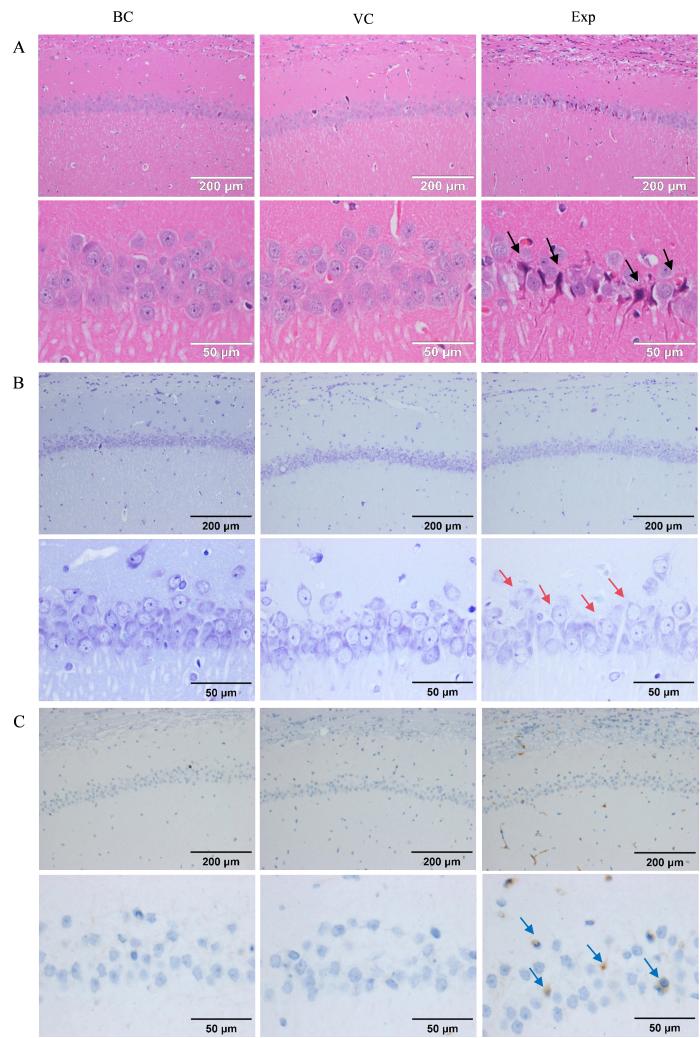
2.4 造模后大鼠海马区组织发生明显的病理学变化
rAAV病毒感染大鼠6个月后,海马体的HE染色结果如图5A所示。实验组大鼠的海马体CA1区神经细胞缺失、皱缩、分布稀疏;空白对照组和空载病毒组CA1区神经元细胞结构完整,细胞数量正常,神经元细胞排列整齐,细胞核大圆且染色清晰。
图5
图5
大鼠海马体组织的HE染色(A)、尼氏染色(B)和免疫组织化学染色(C)结果
Figure 5
HE staining (A), Nissl staining (B), and immunohistochemical staining (C) results of rat hippocampal region
尼氏染色结果如图5B所示。实验组海马体中尼氏体数量减少,分布稀疏,染色浅淡;空白对照组和空载病毒组的海马体中尼氏体丰富,染色可见形态饱满、色深而匀、数量多而密、排列紧致。
免疫组织化学染色结果如图5C所示。实验组大鼠的海马CA1区及锥形细胞层可以看到明显的棕褐色沉淀,即产生了Aβ沉积;空白对照组以及空载病毒组在海马区未看到Aβ沉积现象。
3 讨论
AD作为一种复杂的神经退行性疾病,目前尚无完全治愈该疾病的方法。近20年来,全球首个获美国食品药品监督管理局批准的AD新药仑卡奈单抗,也只能通过清除大脑中的有毒Aβ蛋白,延缓疾病的临床进程。该疾病不仅对患者的身心健康和生活质量造成了极大的危害,也给家庭和社会带来了沉重的负担。近年来,国内外AD患者数量与日俱增,使得该疾病研究刻不容缓,而构建良好的疾病模型对疾病的治疗研究具有至关重要的作用。
灵长类动物与人类的亲缘关系很接近,在构建人类疾病动物模型上具有天然的优势,然而受限于伦理问题和高昂的实验成本,难以作为可推广的实验动物用于研究。所以,目前的AD模型构建大多用大鼠和小鼠。相比于小鼠,大鼠具有更接近人类的神经解剖结构、行为复杂性和代谢特征。本研究在综合考虑成本、病理生理特征及其下游研究价值后,选择大鼠作为构建AD模型的实验动物。
Aβ异常沉积是AD的核心病理标志之一,其生成直接归因于APP的异常剪切[17-18]。家族性AD患者中,约50%的病例与APP基因突变相关,尤其是Swedish、London及Austrian突变,因其对Aβ生成的关键调控作用而被广泛关注。造模时引入人APP基因可规避物种差异,精准模拟人类AD的Aβ沉积特征。本研究采用大脑感染携带Swedish/London/Austrian突变位点的APP基因的病毒进行造模,6个月后组织学观察结果显示,海马区神经元数量减少,形态出现萎缩,尼氏体数量减少,分布稀疏,染色浅淡,出现了明显的Aβ沉积,此变化与人类AD患者的病理特征一致[2]。新物体识别行为学实验发现,实验组大鼠的认知能力显著降低,认知记忆能力衰退,有效模拟了人类AD的临床疾病特征。在现有AD大鼠模型中,也有通过转入APP基因进行造模的文献报道,例如有研究者向Tg6590大鼠转入携带Swedish突变位点的APP基因[19-20],但该模型出现行为认知障碍的时间需9个月甚至更长,出现Aβ沉积的时间在15个月以上,成模时间过于漫长;而且该模型动物出现的AD病理特征比较单一,不如本研究中转入三突变APP基因的造模效果好。
另外,还有研究者直接通过脑立体定位注射Aβ进行造模[24],能在短时间内诱导局部神经炎症,但同时容易激起机体免疫反应,且不符合AD患者脑内Aβ沉积来自长期积累的临床发病机制。而本研究通过高效转导低免疫原性的AAV在大鼠脑内持续表达APP基因,进而形成Aβ沉淀,可以更近似地模拟AD的发病进程。
本实验采用脑立体定位仪直接注射携带APP基因的AAV,利用活体成像仪可快速高效地观察造模效果,对动物创伤小,检测的灵敏度高,无需额外注射易淬灭的荧光抗体或牺牲动物获取组织样本,显著简化了实验流程并符合动物实验伦理的3R原则。此设计不仅为AD病理机制研究提供了高效工具,更为大型动物(如非人灵长类)或难以基因编辑的物种提供了造模参考,规避了转基因动物繁育的高耗时与高成本限制。
综上,本研究通过脑立体定位技术联合AAV转入人源三突变APP基因成功构建的大鼠AD模型,可体现出典型的AD组织病理学和认知行为特征,为基于Aβ沉积的AD病理研究及药物研发提供了动物模型基础。
[引用本文]
肖林林, 杨逸萱, 黎珊杉, 等. 利用脑立体定位技术将人源三突变APP基因导入海马区构建阿尔茨海默病大鼠模型[J]. 实验动物与比较医学, 2025, 45(3): 269-278. DOI: 10.12300/j.issn.1674-5817.2025.030.
XIAO L L, YANG Y X, LI S S, et al. Establishment of a rat model ofAlzheimer's disease by introducing human triple mutant APPgene into hippocampus via brain stereotactic technology[J]. LabAnim Comp Med, 2025, 45(3): 269-278. DOI: 10.12300/j. issn.1674-5817.2025.030.
医学伦理声明
本研究涉及的所有动物实验均已通过广西医科大学实验动物伦理与使用委员会审批(审批号:202404010)。所有实验过程均遵照中国实验动物相关法律法规条例进行。
Medical Ethics Statement
All animal experiments involved in this study were approved by the Ethics and Use of Laboratory Animals Committee of Guangxi Medical University (Approval number: 202404010). All experimental procedures were conducted in compliance with Chinese laws and regulations related to laboratory animals.
作者贡献声明
肖林林负责方案设计、实验操作、统计分析、论文撰写及修改;
杨逸萱、黎珊杉、罗兰诗雨和尹思威协助各项实验的实施;
孙俊铭和施维参与实验指导、论文修改;
欧阳轶强和李习艺负责课题方案设计、实验指导、资金支持,以及论文修改。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
中国阿尔茨海默病报告2024
[J].
China Alzheimer report 2024
[J].
Alzheimer's disease
[J].
Alzheimer's disease
[J].
Comprehensive review on Alzheimer's disease: causes and treatment
[J].
Alzheimer's disease: From immunotherapy to immunoprevention
[J].
Synaptogenic effect of APP-Swedish mutation in familial Alzheimer's disease
[J].
Analysis of non-amyloidogenic mutations in APP supports loss of function hypothesis of Alzheimer's disease
[J].
The Swedish dilemma - the almost exclusive use of APPswe-based mouse models impedes adequate evaluation of alternative β-secretases
[J].
Differential effects of familial Alzheimer's disease-causing mutations on amyloid precursor protein (APP) trafficking, proteolytic conversion, and synaptogenic activity
[J].
AAV-tau mediates pyramidal neurodegeneration by cell-cycle re-entry without neurofibrillary tangle formation in wild-type mice
[J].
Novel App knock-in mouse model shows key features of amyloid pathology and reveals profound metabolic dysregulation of microglia
[J].
Plaque associated microglia hyper-secrete extracellular vesicles and accelerate tau propagation in a humanized APP mouse model
[J].
Transgenic modifications of the rat genome
[J].
An App knock-in rat model for Alzheimer's disease exhibiting Aβ and tau pathologies, neuronal death and cognitive impairments
[J].
AAV vectors: The Rubik's cube of human gene therapy
[J].
Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain
[J].
Pathogenesis of Alzheimer's disease
[J].
Molecular mechanisms of amyloid oligomers toxicity
[J].
A transgenic rat expressing human APP with the Swedish Alzheimer's disease mutation
[J].
Cognitive impairment in the Tg6590 transgenic rat model of Alzheimer's disease
[J].
Microglia prevent beta-amyloid plaque formation in the early stage of an Alzheimer's disease mouse model with suppression of glymphatic clearance
[J].
A novel DPP-4 inhibitor Gramcyclin A attenuates cognitive deficits in APP/PS1/tau triple transgenic mice via enhancing brain GLP-1-dependent glucose uptake
[J].
Cell-mediated neuroprotection in a mouse model of human tauopathy
[J].
Intracerebroventricular injection of amyloid-β peptides in normal mice to acutely induce Alzheimer-like cognitive deficits
[J].
Novel NanoLuc substrates enable bright two-population bioluminescence imaging in animals
[J].
A luciferase prosubstrate and a red bioluminescent calcium indicator for imaging neuronal activity in mice
[J].