异常子宫出血(abnormal uterine bleeding,AUB)是指与正常月经的周期频率、规律性、经期长度、经期出血量中任何1项不符,源自子宫腔的异常出血,是妇科临床常见的症状和体征[1]。正常月经是内膜增殖、蜕膜化、炎症、缺氧、细胞凋亡、止血、血管收缩以及最后的修复和再生之间的良好平衡,这些过程中任何一个不平衡都可能导致子宫内膜表型异常,发生AUB[2]。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)的PALM-COEIN病因分类[3],AUB以非结构性病因为主[4]。但非结构性病因AUB的病理机制尚未完全阐明,缺乏合适的动物模型已成为限制非结构性病因AUB临床前研究的一个主要问题。
目前用于研究非结构性病因AUB的动物模型主要有以子宫出血特征显著而被使用的大鼠不完全流产子宫出血模型[5]、属于排卵功能障碍型AUB(AUB-ovulatory dysfunction,AUB-O)的单一雌激素诱导AUB大鼠模型[6]、属于医源性原因型AUB(AUB-iatrogenic causes,AUB-I)的单一孕激素诱导AUB动物模型[7]、同属于AUB-I分型的节育器AUB动物模型[8]、属于子宫内膜疾病型AUB(AUB-endometrial disorders,AUB-E)的恒河猴炎性AUB模型[9]等,但现有模型存在成因不归属AUB临床病因、子宫无明显出血、实验动物昂贵等多种问题,造模方案没有得到广泛认可。现有AUB-O临床前动物模型的诱导模式单一,不能充分反映临床病理特点,另外也缺少子宫内膜局部纤溶亢进等病因所致的AUB-E动物模型。因此,非结构性病因AUB动物模型领域还存在许多空白,需要继续研发。
本研究根据AUB-O的发病原因,参照雌激素、孕激素预备-植物油诱导-孕激素撤退的“月经”造模模式[10],以SD大鼠为实验材料,构建具有明显AUB-O疾病表型且重复性好的AUB大鼠模型,并将该模型应用于AUB病理机制的研究,以期为非结构性病因AUB相关研究提供模型数据。
1 材料与方法
1. 1 实验动物
24只SPF级10周龄雌性SD大鼠,体重为250~270 g,由北京维通利华实验动物技术有限公司[SCXK(京)2021-0006]提供,质量合格证号为No.110011231109085634。所有大鼠饲养于北京中医药大学实验动物中心屏障设施环境[SYXK(京)2023-0011],饲养环境温度为20~25 ℃,相对湿度为(55±10)%,通风良好,12 h光照/12 h黑暗交替循环,大鼠可自由获取水和食物,大鼠饲料由实验动物中心购自斯贝福(北京)生物技术有限公司,所有器材、垫料和饲料等均在使用前进行灭菌处理。本研究中所有动物实验方案通过北京中医药大学动物实验伦理委员会审查批准(BUCM-4-2022040606-2007),严格执行实验动物使用及照护相关的国家法规及标准。
1. 2 主要试剂与仪器
苯甲酸雌二醇注射液(兽药字163232511)购自上海全宇生物科技动物药业有限公司;黄体酮(即孕酮)注射液(兽药字120031439)购自合肥新科信动物药业有限公司;金龙鱼大豆油(hp724516084440)购自益海嘉里金龙鱼食品集团股份有限公司;米非司酮(M7250)、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(G1120)和高效RIPA组织/细胞裂解液(R0010)均购自北京索莱宝科技有限公司;低温高速离心机(Centrifuge 5810R)为德国 Eppendorf AG公司产品;组织包埋机(HistoCore Arcadia H)、自动切片机(RM2265)和超分辨显微组织成像系统(APERIO VERSA 8)均为德国Leica公司产品;大鼠卵泡刺激素(follicle-stimulating hormone,FSH)ELISA试剂盒(KT3441-A)、大鼠雌二醇(estradiol,E2)ELISA试剂盒(KT3450-A)、大鼠促黄体生成素(luteinizing hormone,LH)ELISA试剂盒(KT40332-A)和大鼠孕酮(progesterone,PROG)ELISA试剂盒(KT3426-A)均购自江苏科特生物科技有限公司;兔抗血小板-内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,CD31)多克隆抗体(28083-1-AP)、兔抗血管内皮生长因子(vascular endothelial growth factor,VEGF)多克隆抗体(YN5444)、兔抗成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)多克隆抗体(YT5549)和兔抗内皮素-1(endothelin-1,ET-1)多克隆抗体(YT5147)均购自美国ImmunoWay公司;小鼠抗基质金属蛋白酶-9(matrix metallo-proteinase-9,MMP-9)单克隆抗体(GB12132)购自武汉赛维尔生物科技有限公司;通用二步法检测试剂盒(小鼠/兔增强聚合物法检测系统,PV-9000)购自北京中杉金桥生物科技有限公司;TUNEL细胞凋亡试剂盒(显色法,B0068)购自北京兰博利德商贸有限公司;蛋白酶和磷酸酶抑制剂混合液(P002)、BCA蛋白定量试剂盒(WB6501)和蛋白上样缓冲液(还原性,WB2001)均购自苏州新赛美生物科技有限公司;高通量研磨仪(LJ-TISS-24)购自山东蓝景电子科技有限责任公司;Omni-Easy™一步法PAGE凝胶快速制备试剂盒(PG212)购自上海雅酶生物医药科技有限公司;10×SDS-PAGE快速电泳液(B2005)、10×快速转膜液(B2006)、封闭专用脱脂奶粉(进口分装,P1622-500)和Super ECL Plus强效超敏发光液(P1050-500)均购自北京普利莱基因技术有限公司;化学发光成像仪(ChemiScope 6100)购自上海勤翔科学仪器有限公司。戊巴比妥钠及手术用耗材均由东直门医院妇科手术室惠赠。
1. 3 分组和模型建立
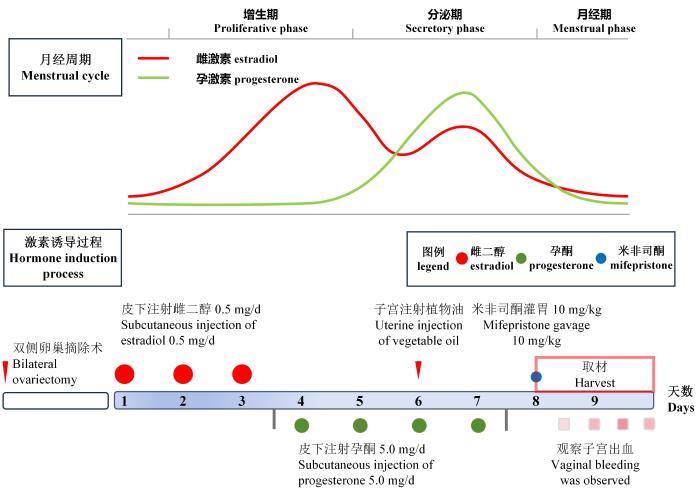
将24只雌性SD大鼠适应性饲养后随机分为正常对照组(Control)6只和模型组(Model)18只,3只/笼,依次编号。正常对照组大鼠在屏障环境中正常饲养,模型组大鼠在屏障环境中经背侧入路行双侧卵巢切除术。术前禁食不禁水,用1 %戊巴比妥钠腹腔注射麻醉(35 mg/kg)后,消毒,俯卧位固定;术中注意减小手术切口,以缩短手术时间;术后大鼠侧卧,保持气道通畅,注意保暖,预防感染。休养1周后开始造模用药。第1、2、3天每日每只大鼠背部皮下注射雌二醇0.5 mg,第4、5、6、7天每日皮下注射孕酮5.0 mg,即皮下序贯注射雌激素和孕激素以诱导子宫内膜增生;同时于第6天经背侧相同切口行二次手术,向双侧子宫腔各注射0.5 mL大豆油,以诱导子宫内膜蜕膜化;然后于第8天灌胃米非司酮(10 mg/kg),以模拟孕激素撤退。将灌胃米非司酮结束时刻记为孕激素撤退0 h,这时向大鼠阴道内置入从医用棉签上取下的干燥医用脱脂棉球(约80 mg),深入阴道约1.5 cm,每12 h更换棉球并记录收集到的子宫出血情况(图1)。
图 1
图 1
月经周期内雌孕激素水平变化示意图和异常子宫出血大鼠模型制备流程图
Figure 1
Schematic diagram of estrogen and progesterone level fluctuations during the menstrual cycle and flowchart of the preparation process for a rat model of abnormal uterine bleeding
1. 4 阴道脱落细胞涂片
随机选取2笼模型组大鼠和2笼正常对照组大鼠,从开始造模用药到孕激素撤退,每日进行阴道脱落细胞形态学观察。取医用棉签蘸取少量生理盐水,深入大鼠阴道大约1 cm,顺时针轻柔转2圈后取出,在载玻片上顺时针滚动均匀铺开脱落细胞,用无水乙醇溶液固定后,浸入亚甲蓝溶液中染色15 min,去离子水漂洗2次,在光学显微镜下观察并记录细胞形态。
1. 5 标本采集与处理
模型组大鼠于孕激素撤退0、12、24、36、48 h,动态收集大鼠血清和子宫组织样本(图1)。用1 %戊巴比妥钠腹腔注射麻醉(40 mg/kg)后,腹主动脉采血,急性大失血法安乐死大鼠后,在大鼠子宫愈合段上方剪取双侧子宫,剪去子宫周围组织。记录子宫的颜色、大小、质地等外观变化,将子宫沿中线剪开分成两份:一份置于体积分数为4 %的甲醛溶液中固定,用于组织学检查;另一份于液氮中速冻,-80 ℃冻存。收集的大鼠动脉血在采血管中颠倒混匀,室温静置,待血液完全凝固、血清析出后,4 ℃条件下3 000 ×g离心10 min,注射器抽取血清,用EP管分装后,冻存于-80 ℃冰箱备用。模型组大鼠孕激素撤退后36 h时的子宫出血特征最明显,取材6只大鼠;其余时刻各取材3只大鼠,共收集到18只模型组大鼠的血清和子宫组织样本。正常对照组6只大鼠在孕激素撤退36 h时,按上述步骤收集正常对照组大鼠的血清和子宫组织样本。
1. 6 HE染色观察大鼠子宫内膜组织病理学变化
大鼠子宫组织经10 %甲醛溶液固定48 h后,放入编号包埋筐,用自来水冲洗过夜。将组织依次进行梯度乙醇脱水,二甲苯透明,浸蜡,使用组织包埋机制备组织蜡块。修块后使用自动切片机进行组织切片(4 μm),切片置于42 ℃水浴中展平,使用多聚赖氨酸处理过的黏附载玻片捞片后甩去水分,放入烘箱37 ℃过夜,烘干的切片于4 ℃保存。将组织切片依次进行二甲苯脱蜡,梯度乙醇和去离子水复水。复水的组织切片浸入苏木精染色液进行细胞核着色10 min,自来水漂洗;浸入酸性乙醇分化液(1 %)分化,自来水漂洗;浸入伊红染色液进行细胞质着色10 min,去离子水漂洗。用梯度乙醇脱水、二甲苯透明和中性树胶封固后,于通风橱中阴干。光学显微镜下观察大鼠子宫病理改变并摄片。
1. 7 ELISA检测大鼠血清FSH、E2、LH和PROG浓度
参照ELISA试剂盒说明书操作,简要步骤包括:配制梯度浓度标准品稀释液,梯度稀释因子为2,在酶标板上设空白孔、标准孔(设置重复孔)和待测样品孔;血清样品稀释,稀释因子为5。标准品稀释液和样品稀释液上样,每孔50 μL,封板37 ℃孵育30 min,浓缩ELISA洗涤液用去离子水稀释为标准浓度,洗涤液洗涤酶标板5次,吸水纸拍干;除空白孔外,其余各孔加入辣根过氧化物酶标记的抗FSH、E2、LH和PROG抗体50 μL,再次封板37 ℃孵育30 min,洗涤液洗涤5次后拍干;各孔先加入过氧化氢50 μL,再加入四甲基联苯胺50 μL,轻轻振荡混匀,避光37 ℃显色10 min,加酸性终止液50 μL终止反应;酶标仪调零后于450 nm波长处测量各孔吸光度(A值),计算标准曲线。根据稀释因子,求得大鼠血清性激素浓度。
1. 8 免疫组织化学法检测子宫内膜中CD31、VEGF和 MMP-9表达
将大鼠子宫组织的石蜡切片,脱蜡复水,浸入柠檬酸钠缓冲液(0.01 mol/L),微波炉加热,温度计显示缓冲液温度升高到98 ℃后维持温度,抗原修复15 min,室温环境下自然冷却,用PBS缓冲液(0.01 mol/L)漂洗切片3次,每次3 min;用免疫组化笔在切片组织周围画圈,在圈定的组织上加入内源性过氧化物酶阻断剂,室温孵育10 min,PBS漂洗3次;用含5 %脱脂奶粉的PBS室温封闭抗原1 h,漂洗3次;分别加入目的蛋白CD31、VEGF、MMP-9的特异性抗体(体积稀释比例为1∶1 000),4 ℃孵育过夜,漂洗3次;加入反应增强液,室温孵育20 min,漂洗3次;加入增强酶标山羊抗兔IgG聚合物或者抗小鼠酶标二抗,室温孵育20 min,漂洗3次;DAB显色,显色终止后再用苏木精对比染色细胞核,封固后于光学显微镜下观察并摄片。应用Image J图像分析软件对各组图片进行多视野图像分析。
1. 9 TUNEL染色检测子宫内膜凋亡情况
将大鼠子宫组织石蜡切片,脱蜡复水后,参照TUNEL染色试剂盒说明书操作。在圈定的组织上依次加入以下试剂并避光孵育:蛋白酶K溶液20 μg/mL,室温20 min;0.3 % H2O2溶液,室温30 min;TUNEL反应液(TdT酶和Biotin TUNEL反应液的体积比为1∶49),37 ℃ 2 h;Streptavidin-HRP工作液,37 ℃ 30 min。每种试剂孵育后用PBS漂洗3次,每次3 min;DAB显色,显色中止后再用苏木精对比染色细胞核,封固后于光学显微镜下观察并摄片。应用Image J图像分析软件对各组图片进行多视野图像分析。
1.10 免疫印迹法检测子宫组织中FGF2和ET-1的表达水平
冻存的大鼠子宫组织样本按照大约1 g∶10 mL的质量体积比,加RIPA细胞裂解液、1 %裂解液体积的蛋白酶和磷酸酶抑制剂混合液,低温振荡研磨离心提取子宫总蛋白,再次滴加蛋白酶和磷酸酶抑制剂混合液,BCA法测定总蛋白浓度。依据蛋白浓度测定结果和统一上样蛋白浓度进行蛋白变性,吸取样品蛋白、RIPA、上样缓冲液于EP管中,100 ℃金属浴加热10 min,离心聚拢变性蛋白,放入-20 ℃冰箱中快速冷却并保存。使用凝胶快速制备试剂盒制胶,统一体积上样,使用快速电泳液恒压200 V电泳30 min,使用快速转膜液恒流350 mA电转35 min,抗原封闭后分别加入目的蛋白FGF2、ET-1的特异性抗体(体积稀释比例为1∶1 000)4 ℃孵育过夜,TBST洗膜3次,每次5 min;孵育标记二抗,洗膜后ECL发光液显影,曝光拍照;膜再生液洗脱,再次封闭后继续按步骤曝光内参蛋白β-actin。用Image J图像分析软件测量各条带灰度值,并进行光密度分析,以目的蛋白与内参蛋白条带测量分析值的比值表示目的蛋白的相对表达水平。
1. 11 转录组学测序分析
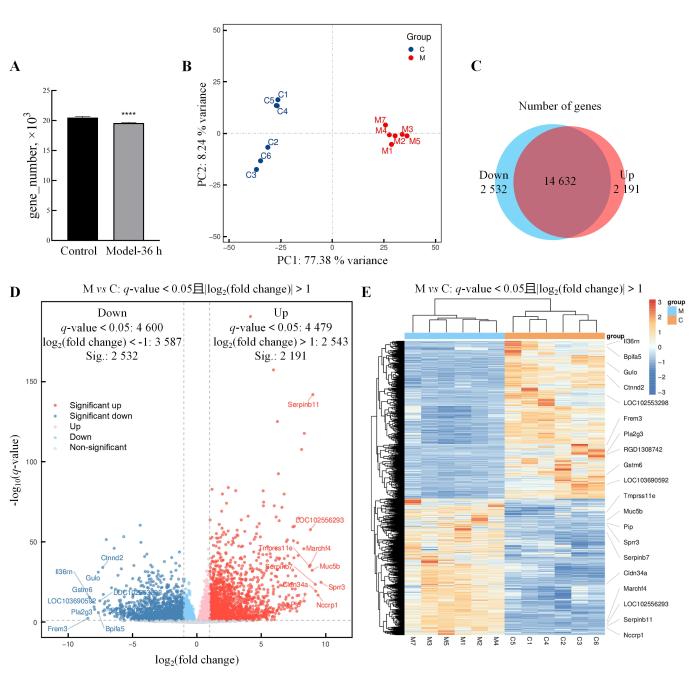
取正常对照组和模型组孕激素撤退36 h(简称Model-36 h)大鼠各6只,每只大鼠均取约100 mg的冻存子宫组织,置于干冰中,运输至上海欧易生物医学科技有限公司进行转录组学测序。测序数据经过清洗获得高质量reads后,比对到参考基因组,计算获得counts数值,得到样本检测的基因数目。计算基因的FPKM定量结果,并进行主成分分析。筛选差异表达基因时,以q-value<0.05并且|log2(fold change)|>1作为标准,绘制火山图,以展示单个基因的表达变化和显著性;绘制差异表达基因分组聚类热图,以展示基因表达模式的整体视图和样本间的聚类关系;对差异表达基因进行GO功能分析和KEGG富集分析,并根据q-value列举出显著上调的前10个基因和显著下调的前10个基因。
1.12 统计方法
对正常对照组(Control)和模型组孕激素撤退36 h(Model-36 h)各6只大鼠的检测数据进行统计,应用SPSS 20.0、GraphPad Prism 8软件进行统计分析和绘图,数据以平均数±标准误(
2 结果
2.1 AUB模型大鼠的动情周期出现变化
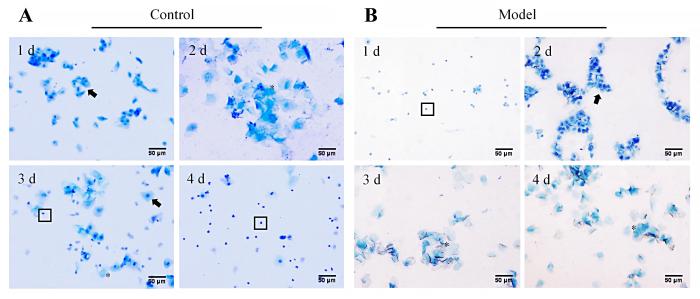
正常对照组大鼠的阴道脱落细胞形态呈周期性改变,以4~6 d为一个动情周期(图2A):动情前期时膨大呈椭圆形的有核上皮细胞占绝大多数,偶见少量白细胞和角化上皮细胞;动情期时绝大多数细胞为外形不规则的角化上皮细胞,聚集在一起形成堆状,如落叶状,可见极少量白细胞和有核上皮细胞;动情后期时不规则角化上皮细胞、有核上皮细胞和白细胞均可见,且比例相当;动情间期时细胞总数较为稀少,以白细胞为主,偶见一些有核上皮细胞。模型组大鼠双侧卵巢切除后,造模用药第1天,由于双侧卵巢切除缺乏内源性雌孕激素,用药前阴道脱落细胞的形态全部静止于动情间期;造模用药第2天,随着外源性雌激素的补充,脱落细胞形态改变呈动情前期;第3天,持续补充外源性雌激素,脱落细胞形态再变为动情期;第4天,序贯补充外源性孕激素,脱落细胞形态持续处于动情期,直到孕激素撤退。结果提示,从卵巢切除到孕激素撤退,模型组大鼠的阴道脱落细胞形态呈非周期性改变(图2B)。
图 2
图 2
异常子宫出血模型大鼠动情周期改变的阴道脱落细胞涂片检测(亚甲蓝染色,×200)
Figure 2
Detection of changes in the estrous cycle in abnormal uterine bleeding model rats using vaginal exfoliated cell smear (methylene blue staining, ×200)
2.2 AUB模型大鼠的子宫组织出现病理学变化
正常对照组大鼠子宫外观呈白色且组织致密,镜下子宫内膜单层柱状上皮排列紧密,间质和腺体结构清晰、染色均匀,子宫内膜可见少量红细胞散在分布于间质中,血管中红细胞个数少(图3A)。模型组大鼠子宫外观偏红、肿胀,镜下子宫内膜上皮细胞和间质细胞(蜕膜细胞)排列松散,间质组织中出现较多红细胞,血管中红细胞淤滞,可见子宫出血(图3B~F):在孕激素撤退0 h,子宫内膜血管中聚集大量红细胞,血管扩张(图3B);12 h后可见内膜明显充血、炎性细胞浸润,功能层局部出现明显的上皮间质坏死脱落和腺体结构破坏,血管进一步扩张伴随结构破坏,红细胞逸散到间质中(图3C);24 h后间质组织中红细胞数量明显增加,部分功能层脱落,出现内膜上皮新生,子宫腔内可见脱落的内膜碎片(图3D);36 h后内膜功能层损伤面积最大,大量内膜组织游离到子宫腔中,子宫出血量达到最大(图3E);48 h后子宫内膜功能层剥脱状态缓解,遗留有蜕膜组织,内膜脱落部分完成上皮新生,遗留蜕膜组织仍可见损伤的血管和坏死的间质细胞(图3F)。
图3
图3
异常子宫出血模型大鼠的子宫外观、出血情况和内膜组织病理变化
Figure 3
Uterine morphology, bleeding patterns, and histopathological changes of endometrial tissues in abnormal uterine bleeding model rats
2.3 AUB模型大鼠血清性激素、子宫疾病相关蛋白表达和内膜细胞凋亡均发生变化
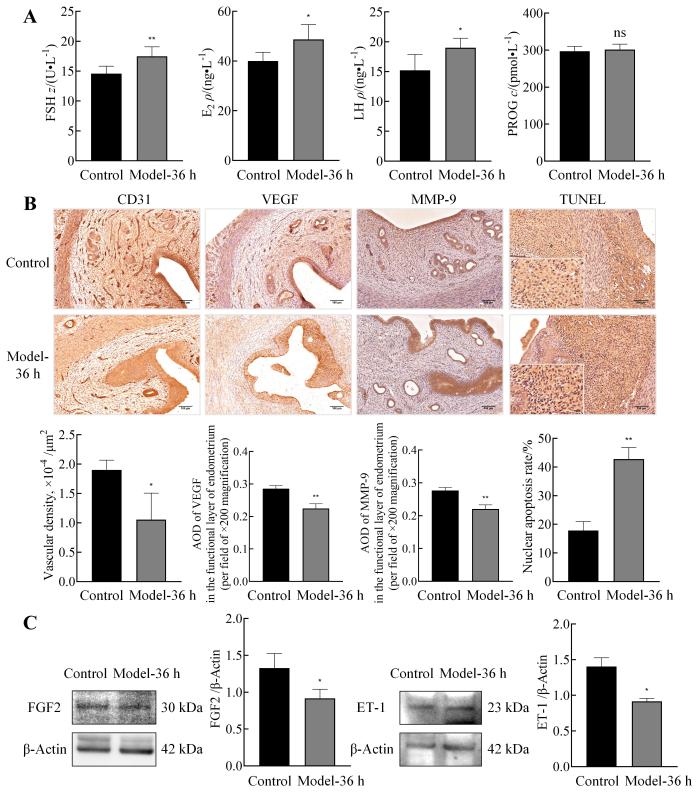
检测大鼠血清性激素水平的ELISA检测结果显示,与正常对照组相比,模型组大鼠在孕激素撤退36 h的血清中FSH、E2和LH水平明显升高(P<0.05),PROG无明显差异(P>0.05,图4A)。免疫组织化学检测结果显示,与正常对照组相比,模型组大鼠在孕激素撤退36 h时CD31标记的子宫内膜血管密度明显降低(P<0.05);VEGF在子宫内膜剥脱处表达明显增强,而在间质血管周围表达水平显著下降(P<0.01);MMP-9在子宫内膜损伤部位表达明显增强,而在未剥脱间质和腺体处表达水平显著降低(P<0.01,图4B)。TUNEL染色后观察发现,与正常对照组相比,模型组大鼠在孕激素撤退36 h时的子宫内膜间质细胞阳性率显著增加(P<0.01,图4B)。蛋白质印迹检测结果显示,与正常对照组相比,模型组大鼠在孕激素撤退36 h时的子宫组织中FGF2和ET-1的表达水平均明显下降(P<0.05,图4C)。
图 4
图 4
异常子宫出血模型大鼠的血清性激素水平、子宫血管和间质的损伤修复情况和血管收缩功能的变化
Figure 4
Changes in serum sex hormone levels, injury and repair of uterus blood vessels and stroma, and vascular contractile function of uterus in abnormal uterine bleeding model rats
2.4 AUB模型大鼠子宫组织的基因表达谱出现变化
转录组学测序结果显示,与正常对照组相比,模型组大鼠在孕激素撤退36 h时子宫组织中的基因表达数量显著降低(P<0.000 1,图5A)。主成分分析结果显示,模型组孕激素撤退36 h大鼠(M)与正常对照组大鼠(C)样本的聚类距离较远,二者在基因表达模式方面存在较大差异(图5B)。差异表达基因分析获得的Venn图和火山图显示,模型组孕激素撤退36 h大鼠与正常对照组大鼠之间共筛选到4 723个差异表达基因(图5C~D),其中表达上调(Up)基因为2 191个,表达下调(Down)基因为2 532个。进一步的分组聚类热图显示,模型组孕激素撤退36 h大鼠子宫组织中表达上调(Up)基因包括RNA调控基因(如Nck1、Actn4)、分化凋亡(如Btc、Olfm4)、免疫(如Tnfaip6、Ceacam1)相关的基因,表达下调(Down)基因包括与炎症过程(如Il36rn、Pla2g3)、细胞黏附(如Ctnnd2、Frem3)相关的基因(图5E)。表1列出了AUB模型大鼠与正常大鼠的差异表达基因中前10个上调和前10个下调基因的基本信息。
图 5
图 5
异常子宫出血模型大鼠子宫组织中差异表达基因的转录组学分析
Figure 5
Transcriptomic analysis of differentially expressed genes in uterine tissue of abnormal uterine bleedingmodel rats
表1 异常子宫出血模型大鼠与正常对照大鼠子宫组织的差异表达基因中前10个上调和前10个下调基因的基本信息
Table 1
编号 No. | 基因符号 Gene symbol | log2差异倍数 log2(fold change) | q值 q-value | 功能概述 Summary |
|---|---|---|---|---|
| Up-regulated genes | ||||
| 1 | Scin | 4.173 | 4.546×10-191 | Predicted to enable actin filament binding activity and phosphatidylinositol-4,5-bisphosphate binding activity. etc. |
| 2 | Btc | 5.961 | 7.347×10-158 | Enables epidermal growth factor receptor binding activity and growth factor activity. etc. |
| 3 | Serpinb11 | 9.021 | 1.630×10-142 | Predicted to enable serine-type endopeptidase inhibitor activity. etc. |
| 4 | Slc16a12 | 6.266 | 9.424×10-126 | Enables creatine transmembrane transporter activity. etc. |
| 5 | Tprg1 | 8.356 | 2.229×10-118 | Predicted to be active in cytoplasm. etc. |
| 6 | Olfm4 | 8.147 | 2.346×10-108 | Predicted to enable cadherin binding activity and structural molecule activity. etc. |
| 7 | Tnfaip6 | 6.344 | 3.099×10-93 | Predicted to enable several functions, including carboxylesterase activity. etc. |
| 8 | Nck1 | 2.451 | 1.127×10-84 | Predicted to enable several functions, including eukaryotic initiation factor eIF2 binding activity. etc. |
| 9 | Actn4 | 1.188 | 1.391×10-83 | Enables ubiquitin protein ligase binding activity. etc. |
| 10 | Tmbim1 | 3.027 | 1.062×10-82 | Predicted to enable calcium channel activity and death receptor binding activity. etc. |
| Down-regulated genes | ||||
| 1 | Gstm5 | -4.393 | 3.077×10-61 | Enables glutathione transferase activity and identical protein binding activity. etc. |
| 2 | Armh4 | -5.671 | 4.422×10-54 | Predicted to enable TORC2 complex binding activity. etc. |
| 3 | LOC102548820 | -7.032 | 2.774×10-52 | - |
| 4 | Arg2 | -4.338 | 1.561×10-50 | Enables arginase activity and nitric-oxide synthase binding activity. etc. |
| 5 | Frem2 | -6.413 | 6.963×10-47 | Predicted to be involved in anatomical structure morphogenesis and cell adhesion. etc. |
| 6 | Mppe1 | -1.346 | 1.575×10-44 | Predicted to enable GPI anchor binding activity. etc. |
| 7 | Lef1 | -3.875 | 3.022×10-43 | Predicted to enable several functions, including DNA binding activity. etc. |
| 8 | Smad9 | -4.048 | 8.538×10-42 | Predicted to enable DNA-binding transcription factor activity, RNA polymerase Ⅱ-specific. etc. |
| 9 | Miga1 | -1.944 | 4.052×10-41 | Predicted to enable protein heterodimerization activity and protein homodimerization activity. etc. |
| 10 | Bmpr1b | -2.515 | 1.387×10-38 | Predicted to enable several functions, including ATP binding activity. etc. |
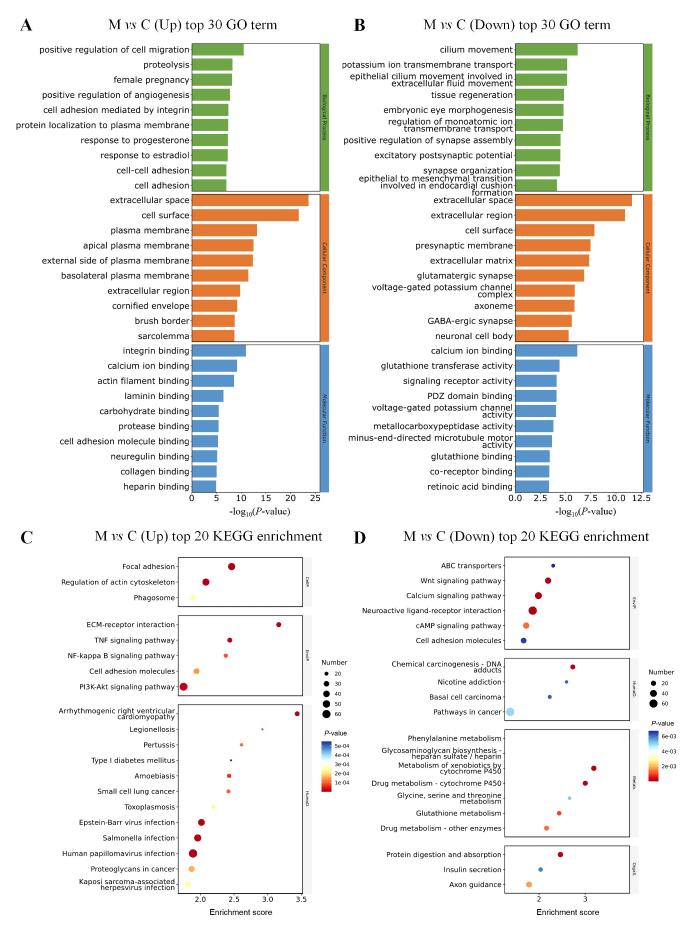
GO功能分析结果显示,表达上调的差异表达基因与细胞黏附、细胞通信、蛋白质定位、细胞迁移、细胞外基质相互作用相关;最显著相关的生物学过程包括细胞黏附、细胞-细胞黏附、对雌二醇的反应等,还有正向调节细胞迁移、正向调节血管生成等;最显著相关的细胞组分包括细胞表面和细胞外基质;最显著的分子功能涉及碳水化合物结合、胶原蛋白结合、肝素结合等(图6A)。表达下调的差异表达基因与细胞分化、突触功能、离子运输、细胞骨架运动以及细胞外基质的组成和功能相关;最显著相关的生物学过程包括上皮到间充质转变、参与心内膜垫形成等细胞分化和组织发育,还有突触组织、兴奋性突触后电位、突触组装的正向调节等神经系统功能;最显著相关的细胞组分包括细胞表面和细胞外基质;最显著的分子功能涉及离子通道和信号转导相关的电压门控钾通道活性和谷氨酸受体活性等(图6B)。
图6
图6
异常子宫出血模型大鼠子宫组织中差异表达基因的转录组学分析
Figure 6
Transcriptomic analysis of differentially expressed genes in uterine tissue of model rats with abnormal uterine bleeding
KEGG富集分析结果显示,表达上调的差异表达基因富集于肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、核因子κB(nuclear factor-kappa B,NF-κB)信号通路和磷脂酰肌醇3激酶-蛋白激酶B(phosphoinositide 3 kinase-protein kinase B,PI3K-Akt)信号通路等,这些通路共同参与了炎症、免疫凋亡、细胞信号转导、增殖分化等生物学过程(图6C)。表达下调的差异表达基因富集于Wnt信号通路、钙离子信号转导通路和环腺苷酸(cyclic adenosine monophosphate,cAMP)信号通路等,这些通路同样参与炎症、免疫凋亡、细胞信号转导、增殖分化等生物学过程,其中钙离子信号转导通路和cAMP信号通路还参与调控肌肉收缩(图6D)。
3 讨论
AUB病因多样,病理生理学机制复杂,属于妇科临床常见病和难治病。在选择实验动物时,发生行经现象的动物可能自发或适合诱导AUB。目前发现的具有行经现象的动物有猿(Hominoidea)、世界猴(Cercopithecoidea)[11]、非洲刺毛鼠(Acomys cahirinus)[12]、黑獒蝙蝠(Molossus ater)[13]和象鼩(Elephantulus myurus)[14]等。自发月经的灵长类动物的子宫是与人类子宫相近,在雌激素和孕激素的作用下历经周期性变化,然而受限于伦理问题和实验成本,难以用于实验研究。其他非灵长类动物由于缺少标准化动物种系、特异性抗体等原因,也不适用于实验。常用的实验动物如小鼠、大鼠、仓鼠和兔等,它们的子宫结构和性激素变化与人类存在显著差异,因此在使用啮齿类动物进行AUB研究时需要诱导其子宫内膜发生人体子宫内膜分泌期蜕膜样改变。
早在20世纪80年代,Finn等[10]在激素控制下通过子宫腔注射花生油诱导小鼠子宫内膜蜕膜化的操作方法,建立了模拟月经小鼠模型。之后月经生理问题的研究大多采用小鼠作为模型动物,遵循雌激素、孕激素预备-植物油诱导-孕激素撤退的造模模式,小鼠有了“月经”后就可以在此基础上开展非结构性病因AUB的实验探索[15]。国内王晓东等[16]通过对早孕大鼠进行抗早孕处理,使大鼠蜕膜化的子宫内膜损伤出血,建立大鼠不完全流产子宫出血模型。该模型的造模周期较短,子宫出血特征明显,但其抗早孕子宫出血的病因不属于AUB的临床病因分类,因此将该模型用于AUB相关研究缺少理论支持。非结构性病因AUB动物模型各有特点[17],但目前仍缺少可观察到子宫出血、符合AUB病因分类且表现出临床AUB-O病理特征的临床前动物模型。
大鼠在操作难度和样本组织收获量方面比小鼠更具优势,而且二者的神经内分泌生殖系统相似——动情周期短、周期黄体寿命短且无功能、缺乏自发的黄体期[18]。因此,大鼠可能同样适用雌激素、孕激素预备-植物油诱导-孕激素撤退的造模模式。本研究结合该造模模式,模拟AUB-O的发病原因,成功建立了AUB大鼠模型。该模型的雌激素和孕激素预备剂量参考了单一雌激素诱导AUB大鼠模型的促进子宫内膜异常增生的雌激素剂量,并模拟月经小鼠模型的孕激素剂量,大鼠子宫注射植物油的剂量与米非司酮药物撤退孕激素剂量则经过多次实验摸索而来,结合观察判断取材时机,使该模型更多地表现出AUB-O的病理特点。
该方法制备的大鼠模型半数可明显观察到子宫出血,可以通过子宫出血判断大鼠子宫内膜的损伤程度。本研究中根据棉球收集到的每12 h子宫出血量,选择对模型孕激素撤退36 h进行重点研究,病理检测结果也证明此时的子宫内膜损伤面积在各取材时间中最大,出血更明显,适用于后续实验研究。AUB模型大鼠表现为子宫内膜功能层剥脱、血管损伤出血、血管收缩止血和再生能力异常、间质和腺体结构破坏,伴有内膜炎性细胞浸润、间质细胞大量凋亡,同时也观察到内膜损伤并不是在子宫内膜功能层同步发生的,子宫内膜表现出复旧不全的特征。
本研究中大鼠AUB模型的特征与非结构性病因AUB-O的临床表现在多个方面趋同。已知下丘脑-垂体-卵巢(hypothalamic-pituitary-ovarian,HPO)轴功能调节或靶器官效应异常可以导致AUB-O的发生。在青春期,HPO轴激素间的反馈调节尚未成熟,大脑中枢对雌激素的正反馈作用存在缺陷,下丘脑和垂体与卵巢间尚未建立稳定的周期性调节,FSH相对峰值呈持续低水平,无促排卵性LH峰形成,卵巢虽有卵泡生长,但卵泡发育到一定程度即发生退行性变,形成闭锁卵泡,无排卵发生,孕激素相对缺乏[19]。在绝经过渡期,卵巢功能不断衰退,卵泡近于耗尽,剩余卵泡往往对垂体促性腺激素的反应性低下,雌激素和孕激素分泌量锐减,特别是孕激素水平先于雌激素下降,促性腺激素水平升高,但不形成排卵期前LH高峰,无排卵发生[20]。本研究中,模型大鼠E2水平受到前期外源性激素控制,后期经过较长时间的生理性回落,在子宫内膜剥脱时E2水平对于诱导增生的内膜相对不足,同时孕激素拮抗剂的使用使孕激素效应相对不足,这与青春期和绝经过渡期的激素缺乏特征一致。此外,临床上AUB患者由于黄体萎缩不全,子宫内膜持续受孕激素刺激,无法按时脱落,导致经血淋漓不尽或大量出血。本研究中模型大鼠的血清孕激素水平与正常大鼠相当,对于需要去除蜕膜组织的大鼠,正常的血清孕激素水平相对“较高”,不利于内膜剥脱,旧的病理性内膜阻碍了新的生理性内膜的再生,结果促进了异常子宫出血的发生;病理染色可见孕激素撤退48 h后模型大鼠子宫内还存在较多量的内膜组织,模型大鼠子宫内膜复旧不全的特点也与AUB-O子宫内膜脱落困难的临床表现[21]一致。而在模拟月经小鼠模型中,蜕膜组织在孕激素撤退48 h内同步崩解脱落,到48 h蜕膜组织碎片完全清除,子宫内膜恢复到蜕膜前的状态[22]。复旧不全是本研究中大鼠模型区别于模拟月经小鼠模型最独特的部分,模型大鼠具有更长的病程,有利于实验研究。另外,模型大鼠残存的内膜组织可能导致大鼠表现出较长时间的疼痛症状,甚至降低大鼠受孕概率,在这些方面与AUB临床病理特征的相似性也需要后续研究的进一步检验。
月经失血过多是子宫内膜疾病型AUB(abnormal uterine bleeding-endometrial disorders,AUB-E)的主要临床症状,内膜修复延迟会导致月经出血时间延长[23]。已有研究表明,VEGF可扩张血管,增加血管通透性,诱导新生血管形成,促进子宫内膜周期性血管修复,其表达降低不利于内膜新血管的生成[24]。FGF2能够促进创伤愈合与组织修复,加速伤口愈合过程,其表达水平降低表明组织损伤后修复能力不足[25]。月经失血过多还与血管活性因子表达失调有关,在月经过多的患者子宫内膜中ET降低,负责其失活的中性内肽酶增加[26]。血管收缩能力直接决定了月经的失血量[27],ET-1通过收缩子宫内膜小动脉来减少月经失血[28]。本研究中AUB大鼠模型的子宫组织中VEGF、FGF2和ET-1表达水平均明显下降,提示模型大鼠的子宫内膜损伤修复能力减弱,血管收缩止血能力受限,这是该模型关键的病理机制之一。这些实验结果与AUB-E的临床表现有许多相同之处,提示该模型可能也适用于AUB-E相关的实验研究。
为了深入探明雌激素、孕激素和米非司酮序贯使用导致大鼠AUB的病理机制,本研究应用转录组学测序的方法,检测分析了模型组和正常对照组大鼠子宫组织中差异表达基因及对应的生物学过程。结果表明,大鼠AUB可能与炎性反应、免疫反应、凋亡过程、细胞增殖分化和肌肉收缩失衡密切相关,这与本研究中的其他实验结果可以相互验证。与表达上调基因显著相关的生物学过程提示,在AUB模型大鼠子宫组织中,与细胞间相互作用和激素信号转导相关的基因表达水平上升,细胞运动和组织重塑增强;显著相关的细胞组分提示,AUB模型大鼠子宫组织中有与细胞外环境相互作用的基因表达增强;显著相关的分子功能提示,模型大鼠子宫组织中与分子识别和细胞黏附相关的蛋白质功能被显著激活。与表达下调基因显著相关的生物学过程提示,模型大鼠子宫组织中细胞分化和组织构建能力下降,神经突触的发育和功能受到了抑制;显著相关的细胞组分提示,模型大鼠子宫组织中有与细胞结构和细胞外环境相关的基因表达水平降低,这可能影响子宫中细胞功能和细胞间通信功能,进而影响组织和器官的整体功能;显著相关的分子功能提示,模型大鼠子宫组织中离子运输和神经信号传递减少。KEGG富集分析结果提示,模型大鼠子宫组织可能具有更强的炎症反应,免疫反应和凋亡受到影响,在细胞信号转导和细胞命运的决定方面也可能发生了改变,细胞增殖和分化活性可能显著降低,钙离子信号转导的肌肉收缩、神经传导、细胞分裂分化活性减弱,由cAMP介导的细胞增殖分化与肌肉收缩功能减弱。Li等[34]的研究也发现,用于治疗AUB的生化汤可以调节包括子宫肌层收缩、子宫内膜重建、免疫系统、血管生成和凝血系统、性激素信号转导以及抗菌活性等多方面有关子宫功能的基因表达,这表明子宫收缩、内膜重建、免疫反应等机制在AUB的发生和治疗中都起到重要作用。诚然,本研究尚缺少对转录组学测序结果的直接实验验证,尚待后续完善。
综上所述,AUB大鼠模型是大鼠子宫在经历雌激素和孕激素促进内膜增生、一定孕激素水平下经植物油诱导内膜蜕膜化[35]、米非司酮给药模拟孕激素撤退后出现的子宫内膜损伤脱落和复旧不全的病理模型,伴有子宫出血现象。相较现有的非结构性AUB模型,本研究中AUB大鼠模型的优势是病理特征明显、造模成本低、条件可控。但需要说明,该模型尚存在一些不足。已知模型动物的子宫内膜病理变化受激素水平影响,孕激素效应的控制是模型制备成功与否的关键。本研究的模型制备采用每日注射的方式调整激素水平,每日注射激素后大鼠体内激素水平快速升高,之后缓慢下降。从整体实验过程来看,人为使模型激素水平上下波动,干扰了模型孕激素效应的控制,因此该模型可以向着优化激素给药模式的方向改进,如将每日激素给药量分多次注射,或者在大鼠体内植入硅橡胶管来缓释激素[36],抑或使用带微调控功能的给药泵控释激素,从而提高模型制备的同质性。再者,给大鼠子宫腔注射植物油诱导蜕膜化的方式需要二次开刀手术,对实验动物的伤害较大,模型动物用于药理学实验会继续增加给药等实验步骤,造模损伤较大可能导致后续实验数据获取量不能达到预期,甚至导致实验失败。因此,可以优化诱导蜕膜化的操作方法,如在大鼠卵巢切除术时尽量减小手术切口,并将切除卵巢后的子宫残端在切口缝合时固定于皮下,二次手术依据切除术入路原位进入,方便尽快找到子宫,同时减少二次手术损伤,或采用腹腔镜注射等方法代替损伤更大的开刀手术[37]。AUB大鼠模型制备过程中,雌激素、孕激素与米非司酮相对剂量可能决定了内膜复旧不全的发生[38-39]。本研究中孕激素用量不足以支持增生子宫内膜充分蜕膜化,米非司酮的实验用量也不足以完全封闭孕激素效应,而临床导致AUB发生的激素紊乱模式并不单一,具体患者的激素水平和变化趋势也不尽相同,本研究中使用的激素用量关系只是其中一种。因此,调整雌激素、孕激素与米非司酮的相对剂量,改变大鼠的激素模式可能会使该模型表现出更多的其他的病理特点。
另外,AUB的临床前模型动物选择也值得进一步深入探讨。相比啮齿类动物,兔作为AUB模型动物可能更有优势。仅从体内诱导蜕膜化一环来看,兔在蜕膜化发生机制上比小鼠和大鼠更接近人类,只给予雌激素和孕激素就可以成功诱导兔子宫发生蜕膜化[40],但本研究未在此方向深入。此外,目前唯一发现具有月经现象的啮齿动物——非洲刺毛鼠,在经过标准化种系培育后用于AUB研究领域也值得期待。
[引用本文]
连辉, 姜艳玲, 刘佳, 等. 异常子宫出血大鼠模型的构建与评价[J]. 实验动物与比较医学, 2025, 45(2): 130-146. DOI: 10.12300/j.issn.1674-5817.2024.132.
LIAN H, JIANG Y L, LIU J, et al. Construction and evaluation of a rat model of abnormal uterine bleeding[J]. Lab Anim Comp Med, 2025, 45(2): 130-146. DOI: 10.12300/j.issn.1674-5817.2024.132.
医学伦理声明
本研究所涉及的所有动物实验方案均已通过北京中医药大学动物实验伦理委员会审查批准(BUCM-4-2022040606-2007)。所有实验操作均遵照中国实验动物相关法律法规条例要求以及北京中医药大学实验动物中心标准操作规程进行。
Medical Ethics Statement
All animal experimental protocols involved in this study have been reviewed and approved by the Animal Experiment Ethics Committee of Beijing University of Chinese Medicine (Approval No. BUCM-4-2022040606-2007). All experimental operations comply with relevant laws and regulations on experimental animals in China and adhere to the standard operating procedures of the Experimental Animal Center of Beijing University of Chinese Medicine.
作者贡献声明
连辉负责文献查阅、实验设计和实行、论文撰写及修改;
姜艳玲、刘佳、张玉立、谢伟负责重复实验、论文修改;
薛晓鸥、李健负责研究指导及论文修改。
利益冲突声明
所有作者均声明本文不存在利益冲突。
数据共享 Data Sharing
本研究中更多组学数据可见本刊官网的附件资料。
参考文献
异常子宫出血诊断与治疗指南(2022更新版)
[J].
Guideline on diagnosis and treatment of abnormal uterine bleeding: 2022 revisions
[J].
Uterine bleeding: how understanding endometrial physiology underpins menstrual health
[J].
The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions
[J].
National survey of abnormal uterine bleeding according to the FIGO classification in Japan
[J].
Parsing the Q-markers of Baoyin Jian to treat abnormal uterine bleeding by high-throughput chinmedomics strategy
[J].
茜草不同炮制品对子宫内膜出血模型大鼠的影响
[J].
Effects of different processed medicine of Rubia cordifolia L on endometrial hemorrhage model rats
[J].
Long-term progestin-only contraception in humans versus animal models
[J].
柴胡止血液对家兔置Cu-IUD的实验研究
[J].
Experimental study on the effect of Chaihu Hemostatic solution on the placement of Cu-IUD in rabbits
[J].
恒河猴子宫内膜炎性出血模型的建立
[J].
Establishment of animal model with metrorrhagia induced by endometritis in experimental Rhesus monkey
[J].
Vascular and cellular changes in the decidualized endometrium of the ovariectomized mouse following cessation of hormone treatment: a possible model for menstruation
[J].
Characteristics of the endometrium in menstruating species: lessons learned from the animal Kingdom
[J].
Characterization of human-like menstruation in the spiny mouse: comparative studies with the human and induced mouse model
[J].
Spontaneous decidual reactions and menstruation in the black mastiff bat, Molossus ater
[J].
Classics revisited: C. J. van der Horst on pregnancy and menstruation in elephant shrews
[J].
The long-term actions of etonogestrel and levonorgestrel on decidualized and non-decidualized endometrium in a mouse model mimic some effects of progestogen-only contraceptives in women
[J].
药物致早孕大鼠子宫出血模型的建立
[J].
Establishment of uterine bleeding model by mifepristoneand misoprostol in eraly-pregnancy rats
[J].
Pre-clinical models to study abnormal uterine bleeding (AUB)
[J].
Neuroendocrine processes in the establishment of pregnancy and pseudopregnancy in rats
[J].
青春期排卵障碍性异常子宫出血的诊疗策略
[J].
Diagnostic and therapeutic strategies for ovulatory dysfunctional uterine bleeding in adolescence
[J].
围绝经期妇女内分泌变化及相关疾病
[J].
Endocrine changes in perimenopausal women and the related diseases
[J].
Mimicking the events of menstruation in the murine uterus
[J].
Hypoxia and hypoxia inducible factor-1α are required for normal endometrial repair during menstruation
[J].
排卵障碍性异常子宫出血患者神经内分泌功能及变化研究
[J].
Research on neuroendocrine function and changes in patients with abnormal uterine bleeding-ovulatory dysfunction
[J].
坤泰胶囊联合米非司酮治疗围绝经期异常子宫出血的疗效及对bFGF、VEGF水平的影响
[J].
Therapeutic effects of Kuntai capsule combined with mifepristone on perimenopausal abnormal uterine bleeding and its influence on bFGF and VEGF levels
[J].
Endothelin and neutral endopeptidase in the endometrium of women with menorrhagia
[J].
Biomarkers in abnormal uterine bleeding
[J].
The role of decidual cells in uterine hemostasis, menstruation, inflammation, adverse pregnancy outcomes and abnormal uterine bleeding
[J].
Cyclooxygenase enzyme expression and E series prostaglandin receptor signalling are enhanced in heavy menstruation
[J].
Reduced levels of VEGF-A and MMP-2 and MMP-9 activity and increased TNF-alpha in menstrual endometrium and effluent in women with menorrhagia
[J].
Physiology of the endometrium and regulation of menstruation
[J].
Endometrial apoptosis and neutrophil infiltration during menstruation exhibits spatial and temporal dynamics that are recapitulated in a mouse model
[J].
孕酮回植通过调节内质网应激诱导的细胞自噬与凋亡阻止小鼠月经发生
[J].
Progesterone replantation to prevent menstruation in mice by regulating endoplasmic reticulum stress-induced autophagy and apoptosis
[J].
Regulation effect and mechanism of Sheng-Hua-Tang on female reproductive system: From experimental transcriptomic analysis to clinical applications
[J].
Mouse model of menstruation: an indispensable tool to investigate the mechanisms of menstruation and gynaecological diseases (Review)
[J].
Granulocytes and vascularization regulate uterine bleeding and tissue remodeling in a mouse menstruation model
[J].
Optimization of endometrial decidualization in the menstruating mouse model for preclinical endometriosis research
[J].
Antiphospholipid antibodies increase endometrial stromal cell decidualization, senescence, and inflammation via toll-like receptor 4, reactive oxygen species, and p38 MAPK signaling
[J].
Menstrual-like changes in mice are provoked through the pharmacologic withdrawal of progesterone using mifepristone following induction of decidualization
[J].
The development and regression of deciduosarcomas and other lesions caused by estrogens and progestins in rabbits
[J].