研究表明,维生素D的生物学功能取决于其活性形式1,25二羟基维生素D[1,25(OH)2D],其与维生素D受体(vitamin D receptor,VDR)结合并调节下游基因转录[7]。在肠上皮细胞中,VDR呈现高表达,亦可调节维生素D的生物活性,并通过VDR信号通路保护肠道上皮屏障,阻滞结肠炎的发生[8]。临床调查显示,在IBD患者血清检查中发现79%的患者缺乏维生素D,且VDR也呈现低表达水平,提示维生素D及其受体可能与IBD发展密切相关[9]。本研究使用H.hepaticus分别感染野生型C57BL/6小鼠和VDR缺失小鼠,然后探究该菌致肠道疾病发生的特性及潜在机制,以期为IBD相关研究提供参考。
1 材料与方法
1.1 菌株和实验动物
菌株H.hepaticus 3B1(ATCC51449)购自美国典型培养物保藏中心(American Type Culture Collection),保存于-80 ℃备用。10只SPF级、VDR缺乏的雄性C57BL/6J小鼠(以下简称VDR-/-)购自江苏集萃药康生物科技股份有限公司[SCXK(苏)2023-0009]。10只野生型雄性C57BL/6J小鼠(以下简称为WT)购自扬州大学兽医学院(比较医学研究院)[SCXK(苏)2022-0009]。所有动物每只体重均为(19±0.5) g,饲养于扬州大学兽医学院动物实验室[SYXK(苏)2022-0044]。环境温度为(22±2)℃,相对湿度为40%~60%,昼夜12 h更替。10只VDR-/-小鼠及10只WT小鼠分别分为感染组和对照组,每组各5只。实验前所有小鼠的螺杆菌属检测均呈阴性。本研究方案经扬州大学实验动物伦理委员会审议通过(审批号202405003)。
1.2 主要试剂和仪器
布氏肉汤和布氏琼脂购自美国BD公司;脱纤维绵羊血、HE染色试剂盒、阿尔辛蓝(alcian blue,AB)-过碘酸希夫(periodic acid Schiff,PAS)染色试剂盒和改良Masson染色试剂盒均购自北京索莱宝科技有限公司;布氏肉汤添加剂购自青岛海博生物技术有限公司;RNA抽提试剂TRIzol购自美国Invitrogen公司;反转录试剂盒和2×ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;兔抗α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)抗体、兔抗白细胞介素(interleukin,IL)-33抗体和兔抗β-actin抗体购自英国Abcam公司;用于免疫组织化学染色的辣根过氧化物酶标记的羊抗兔SignalStainc® Boost IHC Detection Reagent和用于蛋白质印迹的羊抗兔IgG均购自美国Cell Signaling Technology中国分公司;蛋白质印迹检测用AmershamTM ECL Select试剂和BCA蛋白浓度测定试剂盒购自南京碧云天生物技术有限公司。
Thermo Scientific Steri-Cycle™ iCO₂三气培养箱和NanoDrop 2000分光光度计购自美国Thermo公司;T100™ Thermal CyclerPCR扩增仪、Sub-Cell® GT电泳仪和ChemiDoc™ MP Imaging System凝胶成像仪购自美国Bio-Rad公司;StepOne™ 实时荧光定量PCR仪购自美国Applied Biosystems公司;RM2235石蜡切片机和DM1000光学显微镜及DFC450 C摄像系统购自德国Leica 公司。
1.3 细菌培养与模型构建
将H.hepaticus菌液涂于含5%脱纤维绵羊血的布氏琼脂平板上,在37 ℃、微需氧(85%N2,10%CO2,5%O2)环境下培养5 d后,刮取所有菌落并用PBS洗涤,使用分光光度计测量并调整菌液至600 nm吸光度(A值)为1~1.5,此时H.hepaticus浓度约为1×109 CFU/mL(CFU为菌落形成单位,colony-forming unit)。
将10只WT小鼠和10只VDR-/-小鼠随机均分为对照组和感染组,即WT小鼠对照组(WT control)、WT小鼠感染组(WT+H.h)、VDR-/-小鼠对照组(VDR-/-control)、VDR-/-小鼠感染组(VDR-/-+H.h),每组5只小鼠。感染组分别按每只0.2 mL菌悬液(PBS为溶剂,含H.hepaticus约2×108 CFU)进行灌胃,而对照组灌胃等体积PBS。每隔1 d灌胃1次,累积3次,最后一次灌胃后第7天使用螺杆菌属环介导等温扩增(loop-mediated isothermal amplification,LAMP)快速检测方法对感染组所有小鼠进行H. hepaticus定植检测,以LAMP扩增结束后反应管内呈绿色反应液为阳性判定[10],以此判断感染成功与否,并将灌胃完成后第7天作为后续实验初始时间。
1.4 组织采样与收集
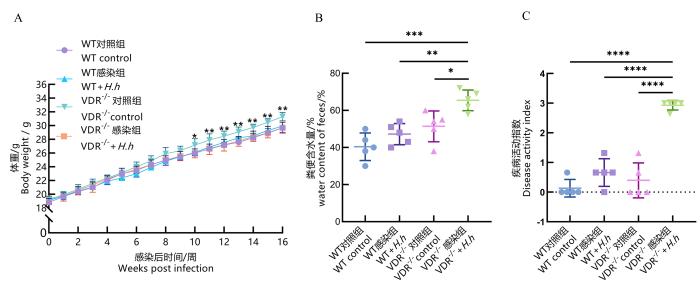
细菌感染成功后称量各组小鼠体重,并在每周日定期称量各组小鼠体重共计16周。同时,计算疾病活动指数(disease activity index,DAI)评分,相关指标包括体重减轻(无体重减轻,0分;1%~5%,1分;5%~10%,2分;10%~15%,3分;>15%,4分 )、大便黏稠度(正常为0分,软便1分,稀便2分,水样便3分)和便血(正常为0分,隐血阳性为1分,明显便血为2分,大量出血为3分)[11]。于感染后第16周,安乐死后收集各组小鼠粪便,测定其含水量,计算公式为:粪便含水量(%)=(原粪便重量-烘干粪便重量)/原粪便重量×100。
使用二氧化碳吸入法将小鼠安乐死后,采集并测量小鼠的结肠长度,用质量分数4%的多聚甲醛溶液固定近端结肠组织后,采用HE染色、AB-PAS染色、Masson染色以及免疫组织化学染色检测组织病理学变化。另取部分近端结肠组织匀浆处理后提取DNA,以16S rRNA为靶基因构建标准品质粒并定量,梯度稀释后作为标准品模板进行实时荧光定量PCR,进行标准曲线绘制后即可通过循环阈值(cycle threshold,Ct)计算DNA拷贝数,从而检测H.hepaticus定植水平[12]。将剩余的中段及远端结肠组织冻存于-80 ℃,液氮研磨后采用反转录PCR(reverse transcription-PCR,RT-PCR)和蛋白质印迹法检测细胞因子转录水平和蛋白水平。
1.5 结肠组织病理学检测
结肠组织固定后脱水,用石蜡包埋、切片(5 μm)后分别进行HE染色、AB-PAS染色和Masson染色,具体操作根据试剂盒说明书进行。最后使用光学显微镜观察组织病理学病变,根据Image-Pro Plus 6.0分析软件计算肠组织的胶原面积,并使用如下评分标准对其进行组织学活动指数(histological activity index,HAI)病理评分。相关指标包括炎症(无,0分;局限于黏膜层,1分;扩展到黏膜下层,2分;扩展到肌层或浆膜层,3分)、水肿(无,0分;轻度,1分;中度,2分;重度,3分)、上皮缺陷(无,0分;隐窝结构轻微变形,1分;隐窝结构明显变形或部分缺失,2分;隐窝结构完全破坏或溃疡形成,3分)、杯状细胞缺失(无,0分;轻度减少,1分;中度减少,2分;重度减少或完全缺失,3分)以及增生(无,0分;隐窝轻度拉长,1分;隐窝明显拉长,2分;隐窝显著拉长或增厚,3分)。
1.6 RT-PCR检测细胞因子转录水平
选取中段结肠组织,液氮研磨后加入1 mL TRIzol,提取结肠RNA,在分光光度计上测260 nm和280 nm处吸光度(A)值。当A260 nm/A280 nm比值为1.8~2.0时,将高纯度RNA用反转录试剂盒获得cDNA,然后在RT-PCR仪上进行扩增,检测IL-1β、IL-6、IL-33、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子β(transforming growth factor-β,TGF-β)和α-SMA等细胞因子基因的mRNA转录水平。引物设计序列见表1。扩增条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火30 s,40个循环。PCR分析得各组内参基因GAPDH和目的基因的Ct值,运用2-△△Ct公式计算目的基因表达量。
表1 PCR引物序列
Table 1
引物名称 Primer name | 基因序列号 Gene ID | 序列 Sequence | 扩增片段长度/bp Amplicon size/bp |
|---|---|---|---|
| TGF-β | 22059 | F: CCACCTGCAAGACCATCGAC; R: CTGGCGAGCCTTAGTTTGGAC | 91 |
| α-SMA | 11475 | F: CCCAGACATCAGGGAGTAATGG; R: TCTATCGGATACTTCAGCGTCA | 104 |
| TNF-α | 21926 | F: CAGGCGGTGCCTATGTCTC; R: CGATCACCCCGAAGTTCAGTAG | 89 |
| IL-1β | 16176 | F: GAAATGCCACCTTTTGACAGTG; R: TGGATGCTCTCATCAGGACAG | 116 |
| IL-6 | 16193 | F: TCTATACCACTTCACAAGTCGGA; R: GAATTGCCATTGCACAACTCTTT | 88 |
| IL-33 | 77125 | F: ATTTCCCCGGCAAAGTTCAG; R: AACGGAGTCTCATGCAGTAGA | 118 |
| GAPDH | 14433 | F: AGGTCGGTGTGAACGGATTTG; R: GGGGTCGTTGATGGCAACA | 95 |
1.7 免疫组织化学法检测IL-33蛋白表达
将结肠组织切片进行脱蜡,水洗3次,3%过氧化氢孵育15 min,水洗3次。用0.1 mmol/L枸橼酸盐进行高温抗原修复,冷却至室温后,再水洗3次。滴加5%牛血清白蛋白,于37 ℃封闭30 min,用PBS溶液水洗3次。加入兔抗IL-33一抗(体积稀释比例为1∶2 000),4 ℃孵育过夜,用PBS洗3次。加入辣根过氧化物酶标记的羊抗兔二抗(体积稀释比例为1∶400),37 ℃孵育30 min,用PBS洗3次。DAB显色3 min,用苏木精对比染色细胞核2 min,再用PBS溶液漂洗3次,晾干,用中性树脂封固,于光学显微镜下观察。IL-33阳性信号为棕色沉淀,细胞核与细胞质均有分布。
1.8 蛋白质印迹法检测纤维化相关蛋白表达
取近端结肠组织,经液氮研磨后加入RIPA裂解液、蛋白酶抑制剂和磷酸酶抑制剂(×100),冰上裂解20 min;4 ℃,12 000 r/min离心15 min,取上清液用BCA蛋白定量试剂盒校准蛋白浓度。取等量蛋白液加入loading蛋白上样缓冲液,于100 ℃煮沸5 min使蛋白变性。在PAGE胶中上样10 μL,电泳(80 V 40 min,120 V 50 min)后转膜(200 mA 60 min),分别与抗IL-33抗体、抗α-SMA抗体、抗β-actin抗体(稀释比例均为1∶1 000)在4 ℃孵育16 h;随后,将膜与辣根过氧化物酶偶联的羊抗兔IgG(稀释比例为1∶20 000)孵育1 h,用Amersham ECL Select试剂检测目的蛋白表达量。
1.9 数据统计分析
在光学显微镜下观察HE染色、AB-PAS染色、Masson染色及免疫组织化学染色结果,记录组织结构、抗原位置及表达量,统计肠道病理学评分;结果数据用平均数±标准差表示,采用非配对双尾t检验进行组间比较。所有结果数据经Graphpad Prism 9软件进行差异分析并制图,P<0.05为差异有统计学意义。
2 结果
2.1 H.hepaticus感染引起VDR-/-小鼠体重减轻和结肠缩短
H.hepaticus三次灌胃后第7天,收集所有感染组小鼠的粪便,使用LAMP快速检测方法进行H.hepaticus定植检测。LAMP扩增结束后,反应管内均呈绿色反应液,提示所有感染组小鼠均成功定植H.hepaticus,即感染成功。如图1A所示,成功感染后第8周,VDR-/-+H.h组小鼠体重增长速度放缓;感染10周后,VDR-/-小鼠体重显著低于VDR-/-小鼠未感染组(P<0.05);而WT、VDR-/-及WT+H.h组之间小鼠体重无显著差异(均P>0.05)。
图1
图1
H.hepaticus感染后各组小鼠的体重变化(A)、粪便含水量(B)和疾病活动指数评分(C)比较
Figure 1
Body weight changes (A), fecal water content (B), and disease activity index score (C) of mice infected by H.hepaticus
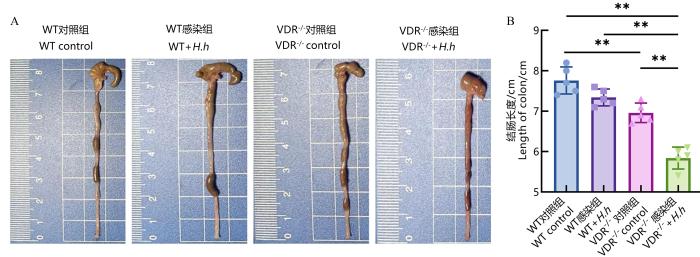
小鼠结肠长度是评估小鼠结肠炎的重要参数。在成功感染后第16周时,与WT小鼠对照组相比,WT+H.h组小鼠结肠明显缩短(P<0.01);与VDR-/-小鼠相比,VDR-/-+H.h组小鼠结肠明显缩短(P<0.01,图2)。此外,与WT小鼠对照组相比,VDR-/-小鼠对照组也出现结肠缩短(P<0.01),而VDR-/-+H.h组小鼠结肠较VDR-/-小鼠相比更短(P<0.01)。
图2
图2
H.hepaticus感染后各组小鼠的结肠长度
Figure 2
Colon length of mice in each group after H. hepaticus infection
综上所述,H.hepaticus感染可引起VDR-/-小鼠结肠炎,并随着感染时间延长,病情加重。
2.2 VDR缺失促进H.hepaticus在小鼠结肠中定植
图3
图3
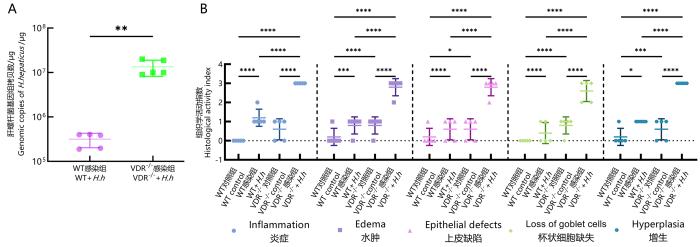
小鼠感染H.hepaticus后的肠道载菌量(A)和结肠组织HAI评分(B)
Figure 3
Colonic bacterial colonization (A) and HAI score of colon tissues (B) in mice infected with H.hepaticus
2.3 H.hepaticus感染致VDR-/-小鼠发生结肠炎和肠纤维化
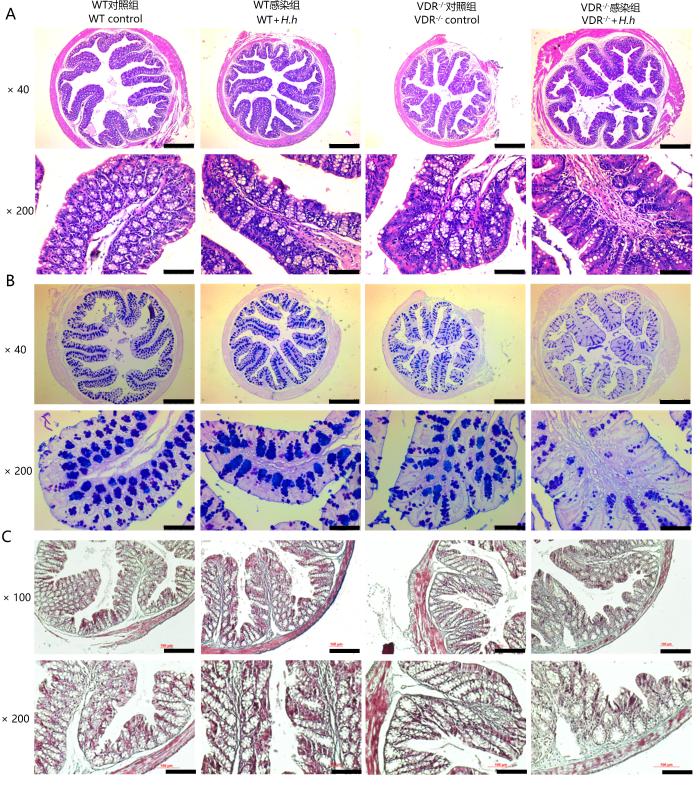
H.hepaticus 感染16周后,取各组小鼠的近端结肠组织进行病理切片染色(图4)。HE染色结果(图4A)显示,VDR-/-小鼠感染组肠道杯状细胞减少,固有层淋巴细胞聚集,隐窝淋巴细胞浸润,部分组织隐窝结构消失,隐窝内肠腺数量减少,且大小形状不规则,黏膜上皮略有增厚;而WT小鼠感染组仅出现轻微的杯状细胞缺失和淋巴细胞浸润;WT和VDR-/-小鼠对照组小鼠肠道结构正常,肠腺清晰,未见明显病变。AB-PAS染色结果(图4B)表明,VDR-/-小鼠感染组肠道杯状细胞缺失,黏液减少,而WT感染组和WT、VDR-/-小鼠对照组肠道结构正常。Masson染色结果(图4C)显示,VDR-/-小鼠感染组肠道胶原纤维增多,肠纤维化程度加重,而WT小鼠感染组胶原沉积较少,WT、VDR-/-小鼠对照组肠道无胶原沉积。综上所述,VDR缺失会促进H.hepaticus感染,引起小鼠肠炎和肠纤维化。
图4
图4
H.hepaticus感染小鼠16周后结肠组织HE染色(A)、阿尔辛蓝-过碘酸希夫染色(B)和Masson染色(C)
Figure 4
HE staining (A), AB-PAS staining (B) and Masson staining (C) of colon tissue of mice infected with H.hepaticus for 16 weeks
2.4 H.hepaticus感染促进VDR-/-小鼠结肠组织中炎症及纤维化因子表达
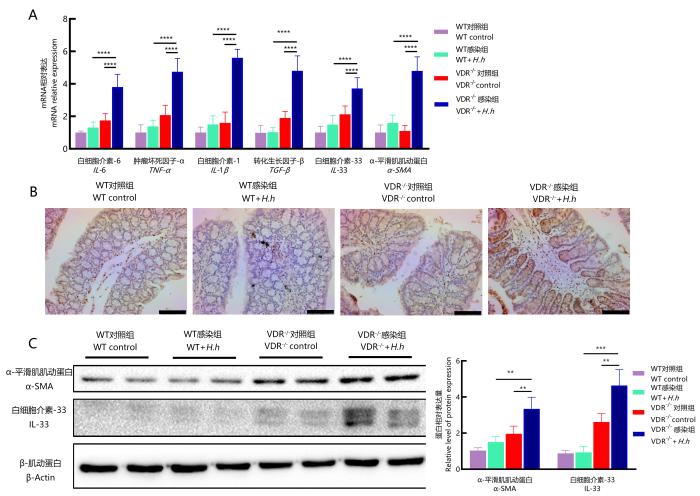
通过比较在VDR-/-和WT小鼠感染H.hepaticus后的结肠组织多种炎症因子的表达水平,探究肠纤维化发病机制。RT-PCR检测结果如图5A所示,在VDR-/-小鼠中,H.hepaticus感染引起促炎和促纤维化因子转录水平升高。具体而言,VDR-/-小鼠感染组主要炎症因子IL-6、TNF-α和IL-1β基因转录水平较WT小鼠感染组明显升高(P<0.000 1),纤维化相关指标α-SMA、TGF-β、IL-33转录水平比WT感染组也明显升高(P<0.000 1)。结果表明,H.hepaticus感染VDR-/-小鼠引起结肠炎性因子和纤维化因子的表达,促进了肠纤维化的发展。
图5
图5
H.hepaticus感染小鼠16周后结肠组织mRNA表达水平检测(A)、IL-33免疫组织化学染色(B)和蛋白质印迹(C)
Figure 5
Detection of mRNA expression levels in colon tissue of mice infected with H. hepaticus after 16 weeks (A), IL-33 immunohistochemical staining (B), and Western blotting (C)
2.5 H.hepaticus感染通过促进IL-33表达和释放引起VDR-/-小鼠肠纤维化
为探究H.hepaticus感染引起VDR-/-小鼠肠纤维化的致病机制,对肠道组织中相关因子表达进行免疫组织化学(图5B)和蛋白质印迹(图5C)检测。α-SMA是反映胶原沉积的重要指标[13]。蛋白质印迹结果显示,VDR-/-小鼠感染组α-SMA蛋白表达水平高于WT感染组(P<0.01),这提示VDR缺乏可导致H.hepaticus促进了肠炎向肠纤维化发展。IL-33是一种多效性细胞因子,参与组织修复,包括纤维化疾病的发生、发展[14]。免疫组织化学和蛋白质印迹结果均显示,与WT小鼠感染组相比,VDR-/-小鼠感染组肠道中IL-33水平升高(P<0.001),提示VDR的缺失引起IL-33表达上调,可能是加剧肠纤维化的原因之一。
3 讨论
IBD临床表现包括持续过度的炎症反应、肠纤维化导致的肠管狭窄以及肠道菌群紊乱等[15],IBD的发病与维生素D水平低有关[9]。H.hepaticus感染小鼠通常为持续性状态,持续性的炎症反应能够使一些免疫缺陷鼠很好地模拟IBD[16-17],但其在免疫健全鼠如C57BL/6中感染症状不明显。本研究使用H.hepaticus感染C57BL/6J及相同背景的VDR-/-小鼠,发现H.hepaticus感染C57BL/6J小鼠后引起了轻微的肠炎症状,而H.hepaticus感染VDR-/-小鼠后出现结肠缩短、黏膜炎性浸润、黏膜组织功能受损、胶原沉积等症状更为明显,并且VDR-/-小鼠未感染对照组无任何病变。本研究在模拟IBD病理改变的同时,能够模拟IBD患者的低VDR信号,可为IBD模型构建及其发病机制和治疗研究提供一定参考。
VDR在多种组织中均有表达(如皮肤、肠道等),具有广泛的生物学功能,参与调控自噬、细胞增殖、肠屏障、肠道微生物群系和免疫反应[18]。本研究发现,VDR缺陷使H.hepaticus感染小鼠模型的DAI评分增加,H.hepaticus定植量增多,肠腺功能受损,这可能与VDR的肠屏障保护功能有关。已有研究表明,VDR通过一系列作用参与维持黏液层和肠道上皮的完整性,如调控紧密连接和黏附连接等成分的表达,以及抗菌肽和黏蛋白的释放[19]。此外,VDR可作为先天免疫对病原微生物威胁反应的关键调节因子,广泛参与免疫调控,发挥免疫抑制功能[20],这可能是H.hepaticus感染VDR-/-小鼠引起了更为严重的炎症反应的原因之一。肠纤维化是IBD的一种临床表现,由于有害刺激未及时消除,造成肠炎伤口愈合延长或中断,于肠黏膜中反复出现并最终形成结缔组织[21]。本研究发现H.hepaticus感染VDR-/-小鼠引起了更高的促纤维化因子(如IL-33、TGF-β)转录水平和更严重的胶原沉积。IL-33在各种屏障部位高度表达,不仅促进伤口愈合和组织修复,还参与炎症和组织修复间失衡引起的纤维化进程,在IBD纤维化中起一定作用[22]。本研究结果显示,IL-33表达水平在VDR-/-+H.h组中显著升高,并且α-SMA表达量上调表明纤维化加剧,这提示VDR信号可能通过抑制IL-33表达来阻止纤维化进程。
综上所述,H.hepaticus感染VDR-/-小鼠成功构建了IBD模型;VDR缺陷导致了肠屏障功能受损和免疫反应紊乱,并通过影响IL-33表达加剧了纤维化进程。H.hepaticus引起VDR-/-小鼠肠纤维化是一种新型模型,相比于常规品系小鼠,H.hepaticus能够在VDR-/-小鼠中长期感染并引起肠炎症状,拓展了H.hepaticus肠炎模型的运用范围。并且,本模型能够模拟IBD患者的低VDR信号特征,可为研究IBD发病机制、探索肠纤维化治疗新措施和筛选治疗新药物提供了新的选择,这具有重要的临床意义。与此同时,H.hepaticus在实验动物群体中广泛传播带来的巨大威胁也应引起高度重视。
[引用本文]
吴志浩, 曹舒扬, 周正宇. 肝螺杆菌感染引起VDR-/-小鼠炎性肠病相关肠纤维化模型的建立及机制探讨[J]. 实验动物与比较医学, 2025, 45(1): 37-46. DOI: 10.12300/j.issn.1674-5817.2024.090.
WU Z H, CAO S Y, ZHOU Z Y. Establishment of an intestinal fibrosis model associated with inflammatory bowel disease in VDR-/- mice induced by Helicobacter hepaticus infection and mechanism exploration[J]. Lab Anim Comp Med, 2025, 45(1): 37-46. DOI: 10.12300/j.issn.1674-5817.2024.090.
医学伦理声明
本研究涉及的所有动物采样及实验过程均严格遵守中国实验动物福利伦理相关法律法规,并通过扬州大学实验动物伦理委员会审查批准(批准号:202405003)。
Medical Ethics Statement
All animal sampling and experimental procedures involved in this study strictly adhere to the relevant laws and regulations on the welfare ethics of experimental animals in China, and have been reviewed and approved by Experimental Animal Ethics Committee of Yangzhou University (Approval No: 202405003).
作者贡献声明
吴志浩负责相关实验操作、数据整理及论文初稿撰写;
曹舒扬负责动物和相关材料提供、模型建立和标本采集;
周正宇负责实验设计、实验结果把关以及文章定稿。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Alteration of gut microbiota in inflammatory bowel disease (IBD): cause or consequence? IBD treatment targeting the gut microbiome
[J].
IBD and environment: are there differences between east and west
[J].
Reduction in diversity of the colonic mucosa associated bacterial microflora in patients with active inflammatory bowel disease
[J].
Pathogenesis of intestinal fibrosis in inflammatory bowel disease and perspectives for therapeutic implication
[J].
Helicobacter hepaticus infection in mice: models for understanding lower bowel inflammation and cancer
[J].
The effects of intestinal microbial community structure on disease manifestation in IL-10-/- mice infected with Helicobacter hepaticus
[J].
Monotropein inhibits colitis associated cancer through VDR/JAK1/STAT1 regulation of macrophage polarization
[J].
Vitamin D deficiency promotes epithelial barrier dysfunction and intestinal inflammation
[J].
Vitamin D deficiency in a European inflammatory bowel disease inception cohort: an epi-IBD study
[J].
螺杆菌属LAMP快速检测方法的研究
[J].
The study of rapid detection of Helicobacter species using loop-mediated isothermal amplification
[J].
Deferasirox alleviates DSS-induced ulcerative colitis in mice by inhibiting ferroptosis and improving intestinal microbiota
[J].
啮齿类螺杆菌SYBR Green Ⅱ荧光定量PCR检测方法的建立
[J].
Establishment of SYBR green Ⅱ based real-time PCR method for detection of Helicobacter rodentium
[J].
Therapeutic targeting of Nrf2 signaling by maggot extracts ameliorates inflammation-associated intestinal fibrosis in chronic DSS-induced colitis
[J].
Pro- and anti-inflammatory roles of interleukin (IL)-33, IL-36, and IL-38 in inflammatory bowel disease
[J].
Unravelling the pathogenesis of inflammatory bowel disease
[J].
Inflammatory bowel disease: an immunity-mediated condition triggered by bacterial infection with Helicobacter hepaticus
[J].
Helicobacter-induced inflammatory bowel disease in IL-10- and T cell-deficient mice
[J].
Vitamin D modulates intestinal microbiota in inflammatory bowel diseases
[J].
Vitamin D regulates claudin-2 and claudin-4 expression in active ulcerative colitis by p-Stat-6 and Smad-7 signaling
[J].
Vitamin D, infections and immunity
[J].
Intra- and inter-cellular rewiring of the human colon during ulcerative colitis
[J].
IL-33/ST2 axis in organ fibrosis
[J].