构建动物模型可以较好地模拟糖尿病的发生发展过程,是研究糖尿病病理改变、发病机制以及潜在炎症机制的一种重要方式[7-8]。目前已有多种不同类型的2型糖尿病啮齿类动物模型,根据模型构建的原理不同,大致可分为诱导型、自发突变型和基因工程型这3种类型[9]。其中,诱导型动物模型以高脂饲料喂养的膳食诱导型与注射链脲佐菌素(streptozotocin,STZ)的化学药物诱导型为主。高脂饲料喂养诱导法通过饮食引发动物体内糖脂代谢紊乱,降低胰岛素敏感性,从而出现胰岛素抵抗。不同品种品系的小鼠对高脂饮食喂养的反应存在差异,同品种品系的小鼠对高脂饮食喂养的反应也存在一定程度的不同。而且STZ诱导法由于血糖迅速升高,容易导致动物酮症酸中毒而死亡[10]。此外,通过基因工程制造2型糖尿病动物模型也有耗时较长、对技术设备和饲养环境要求较高等缺点。相比而言,db/db小鼠是由于瘦素受体基因自发性突变而形成的自发性2型糖尿病模型,不需要额外的诱导条件,且表型稳定,能够在不同的实验环境中重复出现。db/db小鼠早期表现为脂质代谢紊乱,血糖、血脂水平显著升高,糖耐量及胰岛素耐量异常,其高血糖水平能够稳定维持,能较好地模拟人类2型糖尿病胰岛素抵抗的病理进程,是研究2型糖尿病较为理想的模型[11]。已有研究表明,db/m小鼠与db/db小鼠的背景品系相同,且db/m小鼠的体重和血糖一直处于相对正常的水平[12]。故本研究选取db/m小鼠作为对照,可以更好地观察db/db小鼠和db/m小鼠在血糖方面的差异。
本研究以db/db小鼠为糖尿病研究对象,以db/m小鼠为正常对照,通过16S核糖体RNA(16S ribosomal RNA,16S rRNA)测序技术分析db/db小鼠与正常小鼠口腔菌群的组成与差异,旨在为研究糖尿病与口腔菌群之间的关系提供实验数据。
1 材料与方法
1.1 实验动物
选取8只品系为BKS.Cg-Dock7m+/+Leprdb/m,背景为C57BLKS/J的SPF级10周龄雄性db/db小鼠(作为自发性2型糖尿病模型),以及8只10周龄雄性db/m小鼠(作为正常对照),均购自常州卡文斯实验动物有限公司[SCXK(苏)2021-0013],质量合格证编号为320730240100044946。小鼠由常州市第一人民医院[SYXK(苏)2023-0038]购买,饲养于江苏科标医学技术集团有限公司[SYXK(苏)2021-0013]提供的屏障设施。设施环境由中央空调系统自动控制,温度20~25 ℃,相对湿度40%~70%,换气次数为15~20 次/h全新风,有12 h/12 h的光/暗循环。每日为动物提供足够的颗粒料和新鲜的饮用水,其中饲料为常规实验室SPF级鼠粮(主要成分为10%水、18%粗蛋白、4%粗脂肪、5%粗纤维、8%粗灰分及各类氨基酸、维生素与矿物质),由江苏科标医学技术集团有限公司提供;饲料及饮水均经过灭菌处理,饮水瓶每周通过高温高压灭菌一次。动物实验经江苏科标医学技术集团有限公司伦理委员会批准后开展,伦理批件号为IACUC23-0126。
1.2 主要试剂及仪器
一次性无菌鼻咽用尼龙植绒拭子购自广州达佳生物科技有限公司;无菌DNA保存液购自广州市齐云生物技术有限公司(LOT:JR23753A);葡萄糖购自广州泽塔生物科技有限公司;电子分析天平(型号BT25S)为德国Sartorius公司产品;血糖仪及配套血糖试纸(型号ACCU-CHEK Active)为瑞士Roche Diagnostics GmbH公司产品;唾液DNA提取试剂盒购自上海美吉生物医药科技有限公司;JY600C电泳仪购自北京君意东方电泳设备有限公司;GeneAmp 9700热循环仪购自美国Applied Biosystems公司;AxyPrepDNA凝胶回收试剂盒(AP-MN-P-500)购自美国Axygen公司;Miseq基因测序分析仪为美国Illumina 公司产品。
1.3 实验分组
参照文献[21]的方法,本实验共纳入16只小鼠,正常对照组为8只db/m小鼠,糖尿病实验组为8只db/db小鼠。两组小鼠不予其他干预,用相同的鼠笼适应性饲养后,定期给予相同的饮水与饲料,直至实验结束。
1.4 小鼠血糖检测
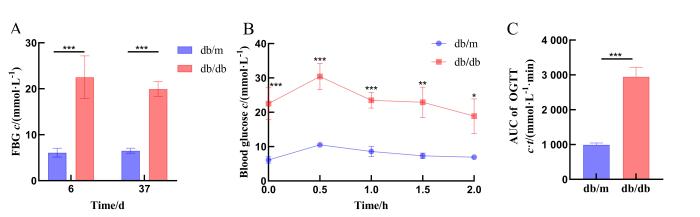
在获取db/db小鼠与db/m小鼠后,对小鼠进行检疫,并进行适应性喂养。小鼠经过5 d的适应性喂养后,在实验正式开始时(实验第1天)首先对每一只小鼠采用耳标方式进行标记。在实验第6天与第37天对两组小鼠行尾静脉取血(采血前禁食12 h,不禁水),用酒精棉球对鼠尾进行消毒并自然风干,用采血针采集尾尖血液,用血糖仪测量空腹血糖(fasting blood glucose,FBG)浓度。FBG测量全部结束后,用50%葡萄糖水溶液(将无水葡萄糖固体按2 g/kg的剂量与生理盐水混合配制而成)对2组小鼠进行灌胃,每只间隔1 min,并在灌胃后的0.5 h、1 h、1.5 h、2 h检测血糖浓度,进行口服葡萄糖耐量(oral glucose tolerance test,OGTT)分析[22]。通过观察血糖浓度的变化来评估小鼠的糖代谢能力,OGTT分析2 h后血糖<7.8 mmol/L说明小鼠对葡萄糖的调节能力正常,而≥11.1 mmol/L说明小鼠可能患有糖尿病。
1.5 口腔菌群收集
在实验开始后的第15天[23],分别对两组小鼠进行口腔菌群的采集。抓取并固定小鼠,用长10 cm的无菌小镊子撑开小鼠口腔,随后用直径2 mm的一次性无菌鼻咽用尼龙植绒拭子分别收集db/m小鼠和db/db小鼠的口腔唾液样本,采样部位包括两侧颊黏膜、舌背与舌腹、口底黏膜、上腭硬区黏膜、上下颌牙龈的龈上区域,每个部位用同一个拭子刮取3次,拭子绒毛浸湿样即为采样合格。然后迅速将拭子放置在装有1 mL无菌DNA保存液的1.5 mL离心管内,用无菌剪刀剪掉棉签柄,残留长度不低于离心管长度的1/2,之后保存于-80 ℃冰箱,并在干冰保存条件下送检。
1.6 细菌基因组DNA提取和16S rRNA illumina测序
根据试剂盒说明书,使用DNA试剂盒提取口腔微生物总DNA。使用1%琼脂糖凝胶电泳检测基因组DNA完整性。使用GeneAmp 9700热循环仪对细菌16S rRNA基因的V3~V4区进行扩增,采用的通用引物为338F(5'-ACTCCTACGGGAGGCAG-CAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。PCR产物使用AxyPrepDNA凝胶回收试剂盒进行纯化回收。在Illumina MiSeq平台上通过双标引扩增和测序方法对口腔菌群结构进行评估,然后应用QIIME(version 1.6.0)软件进行生物信息学分析:通过主坐标分析(principal coordinate analysis,PCoA)揭示样本间的相似性或差异性,通过LEfSe分析、门及属水平菌群差异分析揭示样本间的物种差异,通过α多样性分析评估一个特定区域或生态系统内的物种多样性,通过群落柱状图分析、相对丰度热图分析对样本的群落组成进行分析。
1.7 数据处理及统计分析
采用SPSS软件(Version 26.0)、GraphPad Prism软件(Version 9.0)和R-studio软件(Version 1.0)对血糖及测序数据进行统计学分析以及可视化处理。生物信息学分析结果以平均值±标准差或中位数(四分位数)表示,采用独立样本t检验对正态分布的数据进行两组间比较,采用Mann-Whitney U检验对非正态分布的数据进行两组间比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 db/db小鼠及db/m小鼠的血糖相关指标差异
图1
图1
db/db小鼠及db/m小鼠的血糖相关指标差异
Figure 1
Comparison of blood glucose indices in db/db mice and db/m mice
2.2 db/db小鼠与db/m小鼠的口腔菌群差异
2.2.1 口腔微生物群的结构分析
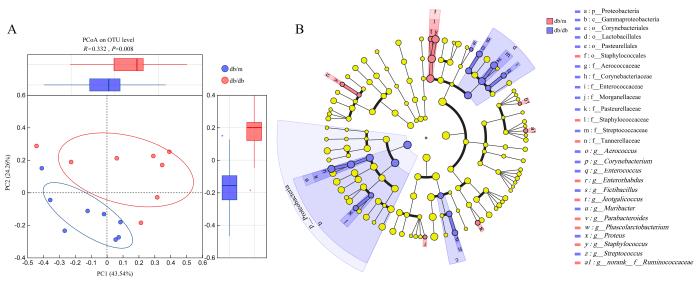
通过针对16S rRNA基因的MiSeq测序分析db/db小鼠及db/m小鼠的口腔菌群差异,结果从16份小鼠口腔样本中获得了2 079 122个有效读数。测序序列以97%的相似性聚类为一个种下单元(operational taxonomic units,OTU),保留至少在3个样本中序列数都≥5的OTU,共获得123种OTU。其中db/db小鼠的OTU为102.30±8.43,而db/m小鼠的OTU为77.25±29.32,2组间OTU差异具有统计学意义(P<0.05)。用R语言(Version 1)进行统计分析和作图,PCoA分析中采用bray_curtis的距离算法,差异检验采用双尾检验,并用错误发现率(false discovery rate,FDR)法进行多重检验校正。db/db小鼠与db/m小鼠的菌落在OTU水平上表现出两组相对离散,样本距离离散值差异显著,群落结构发生显著变化(P<0.05),第一主成分(PC1)和第二主成分(PC2)分别解释了43.54%和24.26%的数据变异,结果如图2A所示。为确定两组群落组成的分类水平,进行了从门水平到属水平的LEfSe分析(图2B)。
图2
图2
db/db小鼠及db/m小鼠口腔菌群结构的PCoA分析和 LEfSe分析
Figure 2
PCoA and LEfSe analysis of oral microbiota composition in db/db mice and db/m mice
在db/db小鼠中,变形菌门(p_Proteobacteria)、变形菌纲(c_Gammaproteobacteria)、巴斯德氏菌目(o_Pasteurellales)、乳杆菌目(o_Lactobacillales)、棒杆菌目(o_Corynebacteriales)、摩根菌科(f_Morganellaceae)、巴斯德杆菌科(f_Pasteurellaceae)、气球菌科(f_Aerococcaceae)、链球菌科(f_Streptococcaceae)、肠球菌科(f_Enterococcaceae)、棒状杆菌科(f_Corynebacteriaceae)、鼠杆菌属(g_Muribacter)、变形杆菌属(g_Proteus)、棒状杆菌属(g_Corynebacterium)、肠球菌属(g_Enterococcus)、链球菌属(g_Streptococcus)、气球菌属(g_Aerococcus)、假芽孢杆菌属(g_Fictibacillus)富集。而db/m小鼠富集了葡萄球菌目(o_Staphylococcales)、葡萄球菌科(f_Staphylococcaceae)、坦纳菌科(f_Tannerellaceae)、副拟杆菌属(g_Parabacteroides)、嗜冷咸海鲜球菌属(g_Jeotgalicoccus)、葡萄球菌属(g_Staphylococcus)、颤螺旋菌科下未分类属(g_unclassified_f_Oscillospiraceae)、瘤胃球菌科下未分类属(g_norank_f_Ruminococcaceae)、肠杆菌属(g_Enterorhabdus)、考拉杆菌属(g_Phascolarctobacterium)。
2.2.2 口腔微生物群的特征
小鼠口腔微生物群的α多样性分析包括物种观测丰富度指数(spieces observed richness index,Sobs)、香农指数(Shannon index,Shannon)、辛普森多样性指数(Simpson diversity index,Simpson)、基于丰度的覆盖估计值(abundance-based coverage estimator index,ACE)、Chao1丰富度估计量(Chao1 richness estimator,Chao1)和测序覆盖度(sequencing coverage,Coverage)。α多样性分析结果显示,db/db小鼠和db/m小鼠之间的Shannon指数、Simpson指数和Coverage指数均没有显著差异(P>0.05),而Sobs指数、Chao1指数和ACE指数具有显著差异(P<0.05)(表1),提示db/db组与db/m组在菌群的多样性上没有显著差异(P>0.05),而在菌群群落的丰富度上具有显著差异(P<0.05)。
表1
db/db小鼠及db/m小鼠口腔菌群的α多样性分析 (n=8,
Table 1
指标 Index | db/m | db/db | P value |
|---|---|---|---|
观察物种指数 Sobs | 10.25±8.43 | 77.25±29.33 | 0.049* |
香农指数# Shannon# | 2.40 (2.25~2.48) | 2.32 (2.23~2.51) | 0.529 |
辛普森指数 Simpson | 0.18±0.04* | 0.16±0.04 | 0.499 |
基于丰度的覆盖估计值 ACE | 105.56±8.34 | 79.49±30.06 | 0.045* |
Chao1丰富度估计量 Chao1 | 105.67±9.78 | 79.25±30.42 | 0.046* |
测序覆盖度 Coverage | 0.999 9 | 1.000 0 | 0.458 |
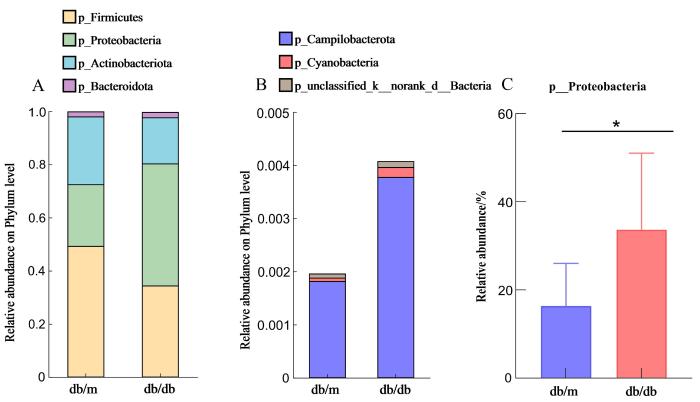
2.2.3 口腔微生物菌群在门水平上的差异
图3
图3
db/db小鼠与db/m小鼠口腔微生物菌群在门水平上的差异
Figure 3
Comparison of oral microbiota between db/db mice and db/m mice at the phylum level
2.2.4 口腔微生物菌群在属水平上的差异
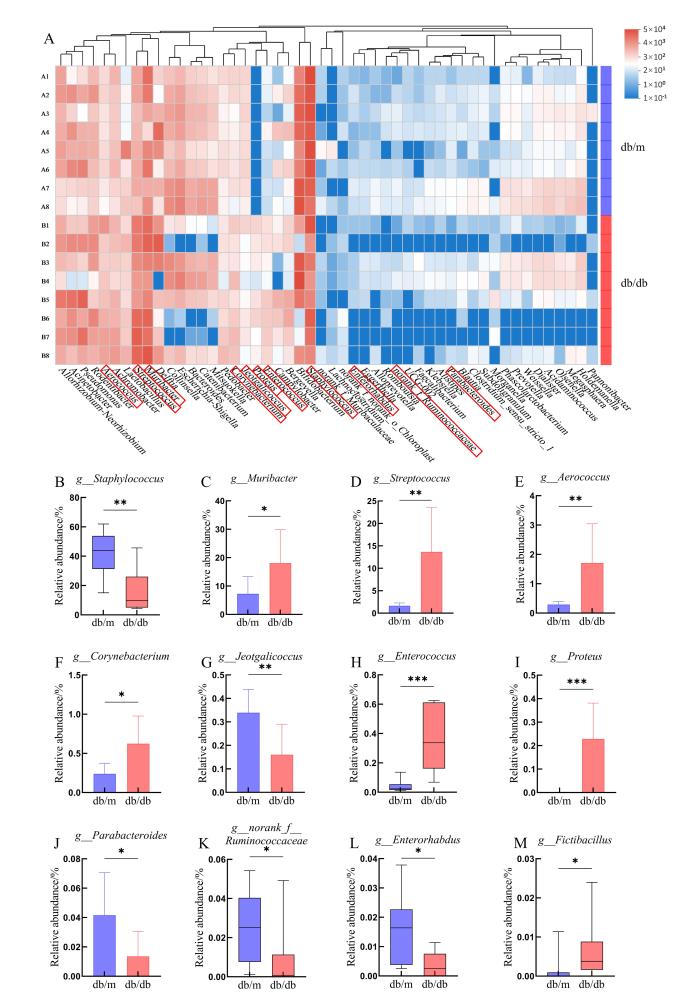
在相对丰度热图中,显示了小鼠口腔菌群在分类学属水平上总丰度前50的详细微生物群组成,如图4A所示。两组小鼠的口腔微生物群在属水平上显示出较大的个体差异,相对主要的菌属是葡萄球菌属(g_Staphylococcus)、鼠杆菌属(g_Muribacter)、链球菌属(g_Streptococcus)、气球菌属(g_Aerococcus)、棒状杆菌属(g_Corynebacterium)、嗜冷咸海鲜球菌属(g_Jeotgalicoccus)、肠球菌属(g_Enterococcus)、变形杆菌属(g_Proteus)、副拟杆菌属(g_Parabacteroides)、瘤胃球菌科下未分类属(g_norank_f_Ruminococcaceae)、肠杆菌属(g_Enterorhabdus)和假芽孢杆菌属(g_Fictibacillus)。与db/m小鼠相比,db/db小鼠中,鼠杆菌属、链球菌属、气球菌属、棒状杆菌属、肠球菌属、变形杆菌属和假芽孢杆菌属的相对丰度显著升高(P<0.05),其中以变形杆菌属和肠球菌属的相对丰度上升最为显著(P<0.001),而葡萄球菌属、嗜冷咸海鲜球菌属、副拟杆菌属、瘤胃球菌科下未分类属和肠杆菌属的相对丰度显著降低(P<0.05)。
图4
图4
db/db小鼠及db/m小鼠的口腔微生物菌群在属水平上的差异
Figure 4
Differences in oral microbiota composition between db/db mice and db/m mice at the genus level
3 讨论
目前,许多学者对糖尿病与口腔菌群之间的关系已经展开过部分研究。李宗泽等[29]通过16S rDNA Amplicon测序法分析了2型糖尿病患者与正常人群的口腔菌群,发现两者口腔菌群的丰度及优势菌属差异无统计学意义,糖尿病患者与正常人群的口腔菌群结构具有相似性,说明糖尿病导致口腔疾病的发生可能并非特异致病菌所致,而是高糖环境导致口腔微生态紊乱。程梦蓉等[30]研究发现,糖尿病患者较健康人群的口腔微生物数目及物种均匀度无明显差异,但口腔致病菌(如普雷沃氏菌、梭杆菌属、消化链球菌属)的比例增加。Gao等[31]从公开数据库的5项研究报告中收集了470个样本数据,对其综合分析后发现2型糖尿病患者口腔菌群中放线杆菌的数量显著增加,但其发病机制还需进一步的临床研究。这些研究表明,2型糖尿病与口腔菌群的关系密切,但其具体联系十分复杂,仍需进一步探索。
动物模型可以较好地模拟疾病的发生发展过程。许多研究者通过构建糖尿病动物模型研究糖尿病与菌群之间的关系。赵玉兰等[32]发现db/db小鼠的血糖升高,骨强度降低,且db/db小鼠与野生型小鼠的肠道菌群多样性及特定菌群丰度存在差异,为研究肠道菌群与糖尿病骨质疏松提供了基础。朱洪杨等[33]通过小鼠模型研究发现,葛根可减轻db/db小鼠胰岛细胞的炎症损伤,改善胰岛素抵抗。彭川等[34]通过16S rRNA技术研究蒌连丸对db/db小鼠肠道菌群的影响,发现在蒌连丸饲喂后db/db小鼠的肠道菌群从门到属水平均发生了变化,有益菌相对丰度增加。刘军等[35]通过16S rRNA基因测序法比较分析了不同品系1型糖尿病小鼠的肠道菌群,发现肠道菌群的组成及比例差异较大,优势菌群在不同品系小鼠模型中的组成比例发生了改变。目前针对糖尿病而开展的动物模型研究结果多以肠道菌群的改变为主,而2型糖尿病小鼠模型的口腔菌群改变尚待深入研究。
本研究运用16S rRNA测序法,通过菌群的α多样性、PCoA分析、物种组成和LEfSe分析探索了db/m对照组小鼠和db/db糖尿病小鼠的口腔菌群差异。结果表明,糖尿病小鼠的口腔菌群结构与对照组小鼠存在差异,两组小鼠的口腔菌群在多样性上无显著差异,而在丰富度上差异显著。这表明糖尿病小鼠出现了口腔微生态的失衡,且这种失衡在多样性上无显著差异,说明并不是外在致病菌定植于口腔内导致的菌群紊乱;而丰富度的差异则表明,这种菌群结构的变化是口腔常驻菌群数量的变化所致,这可能是糖尿病小鼠高血糖的状态改变了口腔内微生态环境导致的变化。有研究发现,糖尿病患者牙周袋内检测出牙龈卟啉单胞菌、福赛坦氏菌、齿垢密螺旋体、伴放线聚集杆菌等牙周可疑致病菌的数量显著增加[36],这也提示糖尿病可能对口腔菌群的组成产生影响。也有学者发现,伴糖尿病的牙周炎患者的龈下菌群组成不同于不伴糖尿病患者,而降血糖治疗有利于改变并重建和谐的口腔菌群生态[37]。口腔微生态失衡与全身健康密切相关,有研究表明,口腔微生态的失衡会对糖尿病小鼠的脾脏免疫产生影响[38],这说明全身的高血糖状态导致口腔微生态失衡,在某种程度上能够造成人体免疫力的降低,从而为机会致病菌提供了致病的可能性。已有文献还表明,糖尿病状态下口腔内的可疑致病菌增多并富集,这些可疑致病菌不仅能够通过牙周袋-血液循环途径引起系统性炎症,进而影响胰岛素信号通路和血糖控制,还能通过口腔-肠道途径来干扰肠道菌群的稳态,导致系统性炎症发生和胰岛素抵抗[39]。这些研究为探索糖尿病与口腔疾病之间的关系提供了思路。与李宗泽等[29]的研究结果不同,本研究发现糖尿病小鼠模型的口腔菌群与正常对照组存在着较为明显的差异,糖尿病小鼠的口腔菌群结构出现了显著变化,在门水平上显示变形菌门丰度上升,而在属水平上以变形杆菌属、链球菌属和气球菌属的相对丰度上升最为显著。其中,变形菌门已经被证实与口腔感染密切相关。这进一步说明,本实验中糖尿病状态造成的以变形菌门丰度升高为主的口腔菌群结构失衡,与口腔疾病的发生发展密切相关。由于变形菌门中的细菌在口腔中常规定植,属于机会致病菌,因此,糖尿病增加其发病机会的机制还需进一步研究。此外,需要说明,菌群分析结果的差异可能与测序方法、样本选择、操作误差等多种因素有关。
综上所述,本研究利用db/db小鼠模型研究了2型糖尿病对口腔菌群的影响,结果显示糖尿病组小鼠的口腔菌群结构在门水平上表现为变形菌门(p_Proteobacteria)丰度上升,而在属水平上以变形杆菌属(g_Proteus)、链球菌属(g_Streptococcus)和气球菌属(g_Aerococcus)的相对丰度上升最为显著,提示2型糖尿病小鼠的口腔微生态环境出现了显著变化。深入了解糖尿病与口腔菌群变化的关系,对于阐明其双向机制,促进口腔与全身健康具有重要的意义。本研究探寻db/db小鼠口腔菌群的改变,为研究糖尿病与口腔菌群的关系提供了新的参考。
[引用本文]
潘钱家, 葛峻沂, 胡楠, 等. 基于16S rRNA测序的2型糖尿病db/db小鼠模型口腔菌群差异分析[J]. 实验动物与比较医学, 2025, 45(2): 147-157. DOI: 10.12300/j.issn.1674-5817.2024.119.
PAN Q J, GE J Y, HU N, et al. Differential analysis of oral microbiota in db/db mouse model of type 2 diabetes utilizing 16S rRNA sequencing[J]. Lab Anim Comp Med, 2025, 45(2): 147-157. DOI: 10.12300/j.issn.1674-5817.2024.119.
医学伦理声明
动物实验方案经江苏科标医学技术集团有限公司伦理委员会审查批准(伦理批件号为IACUC23-0126)。实验遵循GB/T 35892—2018《实验动物 福利伦理审查指南》、GB/T 27416—2014《实验动物机构质量和能力的通用要求》等标准、指南和行业技术规范及科技部《实验动物许可证管理办法》的要求。
Medical Ethics Statement
All animal experiments were approved by the Ethics Committee of Jiangsu Science Standard Medical Testing Co., Ltd. (Approval No. IACUC23-0126) and conducted in strict compliance with GB/T 35892‒2018 Guidelines for Ethical Review of Laboratory Animal Welfare, GB/T 27416‒2014 General Requirements for Quality and Competence of Laboratory Animal Institutions, and Measures for the Administration of Laboratory Animal Licenses (Ministry of Science and Technology, China).
作者贡献声明
潘钱家负责实验方案设计、动物饲养、实验样本收集保存、实验数据分析,并撰写论文初稿;
葛峻沂参与实验动物饲养、样本收集、数据分析及验证;
胡楠参与实验方案的思路和方法设计、实验结果监督与分析;
华飞和顾敏负责对实验的设计与执行进行监督指导,提供实验资源与课题经费支持。
利益冲突声明
所有作者均声明本文无利益冲突。
参考文献
Prevalence of diabetes, epidemiological characteristics and vascular complications
[J].
Obesity and type 2 diabetes mellitus: connections in epidemiology, pathogenesis, and treatments
[J].
Global aetiology and epidemiology of type 2 diabetes mellitus and its complications
[J].
Incident early- and later-onset type 2 diabetes and risk of early- and later-onset cancer: prospective cohort study
[J].
HDL abnormalities in type 2 diabetes: Clinical implications
[J].
Imaging of sarcopenia in type 2 diabetes mellitus
[J].
Disease progression and treatment response in data-driven subgroups of type 2 diabetes compared with models based on simple clinical features: an analysis using clinical trial data
[J].
Animal models as tools to investigate antidiabetic and anti-inflammatory plants
[J].
Ⅱ型糖尿病动物模型构建的研究进展
[J].
Research progress in the construction of type Ⅱ diabetes animal models
[J].
糖尿病动物模型构建的研究进展
[J].
Research progress on the construction of animal model of diabetes mellitus
[J].
Animal models of metabolic syndrome: a review
[J].
自发性2型糖尿病模型db/db小鼠生物学特性研究
[J].
Biological characteristics of spontaneous type 2 diabetes mellitus model db/db mice
[J].
Human oral microbiota and its modulation for oral health
[J].
口腔菌群与口腔疾病及全身性疾病关系的研究进展
[J].
Research progress on the relationship between oral flora and oral diseases and systemic diseases
[J].
Oral microbiome in health and disease: maintaining a healthy, balanced ecosystem and reversing dysbiosis
[J].
Regulatory effects of oral microbe on intestinal microbiota and the illness
[J].
The bidirectional biological interplay between microbiome and viruses in periodontitis and type-2 diabetes mellitus
[J].
Bidirectional association between periodontal disease and diabetes mellitus: a systematic review and meta-analysis of cohort studies
[J].
Novel insight into the mechanisms of the bidirectional relationship between diabetes and periodontitis
[J].
The bidirectional association between diabetes and periodontitis, from basic to clinical
[J].
实验性牙周炎对小鼠焦虑样行为及肠道菌群的影响
[J].
Effects of experimental periodontitis on anxiety-like behavior and gut microbiota in mice
[J].
基因缺陷型2型糖尿病模型动物db/db小鼠早期生物学特性研究
[J].
Research on early biological characteristics of gene defect type 2 diabetes model db/db mice
[J].
A20通过抑制自噬缓解实验性牙周炎牙槽骨吸收
[J].
A20 alleviates alveolar bone loss in experimental periodontitis by inhibiting autophagy
[J].
Association of non-alcoholic fatty liver disease with cardiovascular disease and all cause death in patients with type 2 diabetes mellitus: nationwide population based study
[J].
Cardiovascular-kidney-metabolic (CKM) syndrome: a state-of-the-art review
[J].
Association between pulp and periapical disease with type 2 diabetes: a bidirectional Mendelian randomization
[J].
Oral flora and functional dysbiosis of cleft lip and palate patients: a scoping review
[J].
Oral microbiota-host interaction: the chief culprit of alveolar bone resorption
[J].
16S核糖体DNA Amplicon测序法分析2型糖尿病患者口腔微生物多样性
[J].
Analysis of oral microbial diversity in patients with type 2 diabetes mellitus by 16S ribosome DNA Amplicon sequencing
[J].
β-羟基丁酸对糖尿病患者口腔菌群结构和丰度的调节作用
[J].
Modulatory effect of β-hydroxybutyrate on the structure and abundance of oral microbiota in diabetic populations
[J].
Cross-cohort microbiome analysis of salivary biomarkers in patients with type 2 diabetes mellitus
[J].
2型糖尿病db/db小鼠骨强度和肠道内容物菌群的变化
[J].
Changes of bone strength and gut microbiota in type 2 diabetic db/db mice
[J].
基于肠道菌群分析探讨葛根减轻T2DM db/db小鼠胰岛素抵抗的作用及机制
[J].
Effect and mechanism of Puerariae Lobatae Radix in alleviating insulin resistance in T2DM db/db mice based on intestinal flora
[J].
基于16S rRNA技术研究蒌连丸对2型糖尿病db/db小鼠肠道菌群的影响
[J].
Effect of Loulianwan on gut microbiota in db/db mice with type 2 diabetes mellitus based on 16S rRNA sequencing technology
[J].
应用16S rRNA基因测序比较分析不同品系1型糖尿病小鼠肠道菌群的异同
[J].
Use of 16S rRNA sequencing for comparative analysis of gut microbiome in different strains of type 1 diabetic mice
[J].
Quantification of key periodontal pathogens in insulin-dependent type 2 diabetic and non-diabetic patients with generalized chronic periodontitis
[J].
Effects of type 2 diabetes and metformin on salivary microbiota in patients with chronic periodontitis
[J].
Human periodontitis-associated salivary microbiome affects the immune response of diabetic mice
[J].
牙周炎与糖尿病关联机制的研究进展
[J].
Advances in research on the mechanism of association between periodontitis and diabetes mellitus
[J].