1 材料与方法
1.1 实验动物
实验分4组:10周龄SHJH hr 小鼠、10周龄ICR小鼠、24周龄SHJH hr 小鼠和24周龄ICR小鼠,每组6只,均为雄性[14],由上海吉辉实验动物饲养有限公司[SCXK(沪)2017-0012]提供。动物饲养于上海大学转化医学院[SYXK(沪)2019-0020]和复旦大学附属中山医院[SYXK(沪)2021-0022]的屏障设施中。饲养环境温度为(22±2)℃,相对湿度为50%~60%,12 h自动昼夜循环,小鼠可自由进食进水。所有动物实验方案均经复旦大学附属中山医院动物伦理委员会(批号2021-05-07)和上海大学科技伦理委员会审查通过(批号ECSHU2020-101),并按照美国国立卫生研究院的《实验动物护理和使用指南》以及中国实验动物使用相关标准进行实验操作。
1.2 试剂耗材
组织固定液即4%中性甲醛溶液(FNB4-5L)、苏木素伊红(hematoxylin-eosin,HE)染色液(HE-3-500)和Masson三色染色试剂盒(MST-100T)均购自上海科汇生物技术有限公司;iFluor488-麦胚凝集素(wheat germ agglutinin,WGA)染色试剂(绿光,G1730-100UL)和DAPI染色试剂(G1012-10ML)均购自武汉赛维尔生物科技有限公司;荧光猝灭剂(P0128S)和Bradford蛋白浓度测定试剂盒(P0006)购自上海碧云天生物技术股份有限公司;丙二醛(malondialdehyde,MDA)含量检测试剂盒(BC0025)以及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)、过氧化氢酶(catalase,CAT)活性检测试剂盒(货号分别为BC0175、BC1190、BC0205)均购自北京索莱宝科技有限公司;8-羟基-2'-脱氧鸟苷(8-hydroxy-2'-deoxyguanosine,8-OHdG)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定试剂盒(impELM14205-48T)购自上海毕合生物化学技术有限公司;实时荧光定量PCR试剂盒(TB Green,RR420)、RNA提取试剂(TRIzol,9108)和反转录试剂盒(RT Master Mix,RR036)均购自日本TaKaRa公司;移液器枪头、离心管、冻存管等常用耗材均购自无锡耐思生命科技股份有限公司。
1.3 仪器设备
超高分辨率小动物活体超声影像系统(Vevo2100)购自加拿大VisualSonics公司;酶标仪(Infinite E Plex)购自瑞士TECAN公司;研究级全玻片扫描系统VS200(含普通白光和荧光显微镜)购自日本Olympus公司;动物用气体麻醉机购自美国Dwyer仪器仪表制造公司;qTOWER³ 系列PCR仪购自德国Analytik Jena AG公司。
1.4 心脏超声检测
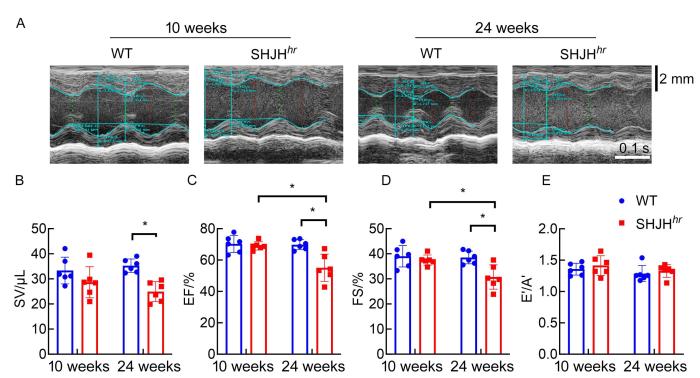
取10周龄、24周龄的SHJH hr 小鼠(即SHJH hr 组)和ICR小鼠(即WT组)各6只,一共24只。4种小鼠经适应性饲养3 d后,进行心脏超声检测。具体步骤:小鼠放入麻醉诱导盒中,应用异氟烷气体进行麻醉,将已麻醉的小鼠以仰卧姿势固定在动物操作平台上;将小鼠口鼻塞入麻醉面罩,以体积分数为2%、流量为0.41 mL/min的异氟烷维持麻醉;在动物操作平台的电极涂上导电膏,并用医用胶带将小鼠的爪子固定在电极垫上,确保采集到正确的心电图,其间维持小鼠体温,并检查呼吸频率;将脱毛膏涂抹在小鼠的胸部和上腹部,2 min后用湿纱布或湿纸巾擦去脱毛膏,用生理盐水擦拭干净;调整探头位置,避免压迫心脏,进行数据采集。左心室胸骨旁长轴视图用于左心室容量和功能评估,取心尖四腔切面检测小鼠心脏舒张功能。心功能指标中每搏输出量(stroke volume,SV)、射血分数(ejection fraction,EF)和缩短分数(fractional shortening,FS)主要反映心脏的收缩功能,二尖瓣前向血流e峰与a峰的比值(E'/A')主要反映心脏的舒张功能。
1.5 脏器称重
随机选取10周龄和24周龄的WT小鼠和SHJH hr 小鼠各6只,禁食过夜,取静脉血后,采用颈椎脱臼法实施动物安死术。分离并收集小鼠肺脏和心脏,称取其重量,然后固定保存心脏组织,用于后续的病理学分析和分子生化检测。脏器重量用胫骨长度进行校准,即以肺或心脏重量/胫骨长度比率反映肺或心脏的萎缩情况。
1.6 HE染色和Masson染色检测心脏组织病理
将24周龄的WT小鼠和SHJH hr 小鼠(各6只)心脏组织经固定液固定48 h后,经过逐级脱水透明处理后进行石蜡包埋,随后行5 μm切片。分别用HE染色液及Masson三色染色试剂盒进行染色,然后用光学显微镜观察心脏组织的病理变化并拍照。HE染色主要反映组织细胞坏死、水肿、变性和炎性细胞浸润等异常病理学改变; 而Masson 染色主要反映组织纤维化。最后,使用Image-Pro Analyzer 7.0软件定量分析心脏组织纤维化情况,并用Image J图像分析软件计算胶原纤维面积与组织总面积的比值,该比值越大表示纤维化程度越严重。
1.7 WGA染色检测心肌细胞面积
将24周龄的WT小鼠和SHJH hr 小鼠(各6只)心脏组织切片经脱蜡、抗原修复,加入WGA工作液,温箱中孵育1 h。随后用DAPI对比染色细胞核,并在加入荧光猝灭剂后进行固定。最后使用荧光显微镜捕获和分析图像,并使用Image-Pro Analyzer 7.0软件定量分析心肌细胞面积。
1.8 ELISA法和比色法检测心脏组织中氧化损伤指标
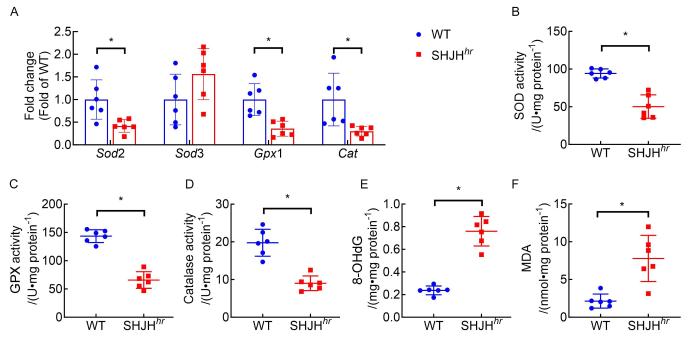
取24周龄的WT小鼠和SHJH hr 小鼠(各6只)左心室心尖位置组织,制备组织匀浆,根据ELISA试剂盒生产商提供的说明书,用相应试剂盒检测心脏组织中氧化损伤相关酶SOD、GPX和CAT的活性,以及氧化应激标志物8-OHdG和MDA的含量。然后,使用酶标仪测量吸光度,绘制标准曲线,计算每组样本中各生化指标的活性或含量。
1.9 实时定量PCR法检测相关因子表达水平
取24周龄的WT小鼠和SHJH hr 小鼠(各6只)左心室心尖位置组织,应用TRIzol试剂提取心脏组织中总RNA,用RT Master Mix试剂盒反转录生成 cDNA。然后以cDNA为模板,应用实时荧光定量PCR试剂盒进行检测。目的基因包括氧化应激相关因子Sod2、Sod3、Gpx1和Cat,炎症因子Il1β、Il6、Tnf和Ccl2,纤维化因子Tgfβ1、Col1α1和Actα2,以及内参基因GAPDH的引物序列见表 1。PCR反应条件:95 ℃预变性反应5 min,95 ℃变性反应10 s,60 ℃退火反应30 s,设置35次循环。通过2–ΔΔCt 法计算目的基因的mRNA相对水平。
表1 目的基因的PCR引物序列
Table 1
基因名称 Name of genes | 引物序列 Sequence (5’→3’) |
|---|---|
| Sod2 | CAGACCTGCCTTACGACTATGG; CTCGGTGGCGTTGAGATTGTT |
| Sod3 | CCTTCTTGTTCTACGGCTTGC; TCGCCTATCTTCTCAACCAGG |
| Gpx1 | CCACCGTGTATGCCTTCTCC; AGAGAGACGCGACATTCTCAAT |
| Cat | GGAGGCGGGAACCCAATAG; GTGTGCCATCTCGTCAGTGAA |
| Il1β | GCAACTGTTCCTGAACTCAACT; ATCTTTTGGGGTCCGTCAACT |
| Il6 | CCAAGAGGTGAGTGCTTCCC; CTGTTGTTCAGACTCTCTCCCT |
| Tnf | CACGCTCTTCTGTCTACTGAACTTC; CTTGGTGGTTTGTGAGTGTGAGG |
| Ccl2 | TAAAAACCTGGATCGGAACCAAA; GCATTAGCTTCAGATTTACGGGT |
| Tgfβ1 | CCACCTGCAAGACCATCGAC; CTGGCGAGCCTTAGTTTGGAC |
| Col1α1 | GCTCCTCTTAGGGGCCACT; ATTGGGGACCCTTAGGCCAT |
| Actα2 | GTCCCAGACATCAGGGAGTAA; TCGGATACTTCAGCGTCAGGA |
| GAPDH | AGAAGGTGGTGAAGCAGGCATC; CGAAGGTGGAAGAGTGGGAGTTG |
Note: Sod2, superoxide dismutase 2; Sod3, superoxide dismutase 3; Gpx1, glutathione peroxidase 1; Cat, catalase; Il1β, interleukin 1 beta; Il6,interleukin-6; Tnf, tumor necrosis factor; Ccl2, chemokine (C-C motif) ligand 2; Tgfβ1, transforming growth factor beta 1; Col1α1, collagen, type I, alpha-1; Actα2, actin alpha cardiac muscle 2; GAPDH, glyceraldehyde-3-phosphate dehydrogenase.
1.10 统计学分析
实验结果使用平均数±标准差(
2 结果
2.1 24周龄SHJH hr 小鼠的心功能减退
图1
图1
心脏超声检测不同周龄SHJH hr 小鼠的心脏功能
Figure 1
Cardiac ultrasound examination of SHJH hr mice cardiac function at different ages
2.2 24周龄SHJH hr 小鼠出现心脏萎缩
图2
图2
不同周龄SHJH hr 小鼠的肺脏和心脏重量
Figure 2
Lung and heart weights of SHJH hr mice at different ages
2.3 24周龄SHJH hr 小鼠心肌细胞面积减少
图3
图3
24周龄SHJH hr 小鼠的心脏组织病理和相关因子转录水平分析
Figure 3
Analysis of cardiac histopathology and related factor transcriptional levels in 24-week-old SHJH hr mice
2.4 24周龄SHJH hr 小鼠心脏组织中氧化损伤指标观察
将24周龄的WT小鼠和SHJH hr 小鼠心肌组织进行实时荧光定量PCR法检测,结果发现:与WT小鼠相比,SHJH hr 小鼠心肌组织中氧化应激因子Sod2、Gpx1和Cat基因的mRNA水平明显降低(均P<0.05),而Sod3的mRNA水平没有显著变化(P>0.05,图4A)。
图4
图4
24周龄SHJH hr 小鼠的心脏组织氧化损伤相关因子分析
Figure 4
Analysis of oxidative damage-related factors in cardiac tissue of 24-week-old SHJH hr mice
3 讨论
本研究基于SHJH hr 自发性早衰小鼠,探索其是否存在心脏衰老改变,为SHJH hr 小鼠应用于心脏衰老研究提供依据。本研究中心脏超声检查发现,SHJH hr 小鼠在生长到24周龄时,心脏收缩功能指标SV和EF显著低于WT组小鼠,提示SHJH hr 小鼠在24周龄已经出现自发性心功能减退;结合心衰模型标准[18],说明心脏功能自发性早衰模型构建成功。脏器称重发现,SHJH hr 小鼠心脏在24周龄时出现萎缩,但是肺脏重量未出现变化;这提示尽管24周龄的SHJH hr 小鼠心脏萎缩,心脏功能出现下降,但是尚未出现心衰现象,肺脏未发生水肿。
随后针对24周龄小鼠进行心脏组织学观察时,WGA染色发现SHJH hr 小鼠的心肌细胞面积明显减少,这说明hr突变会导致心肌细胞萎缩,从而加剧心脏功能下降。最后对24周龄小鼠的心肌组织氧化损伤因子进行了ELISA检测,结果发现hr突变会下调SOD、GPX和CAT活性,促进氧化应激标志物8-OHdG表达,这些结果说明hr突变诱发抗氧化系统功能障碍和心肌组织氧化应激损伤。心脏生理性衰老与氧化应激之间存在密切关系。氧化应激是指体内氧化与抗氧化作用失衡的一种状态,倾向于氧化会导致细胞损伤和衰老。在心脏衰老过程中,氧化应激被认为是核心环节之一,直接导致细胞损伤,如内质网应激、细胞凋亡和铁死亡等 [19]。但必须指出的是,在24周龄的SHJH hr 小鼠心脏组织中未观察到明显的炎症和纤维化,而炎性细胞浸润和组织纤维化是心脏衰老发生的重要标志[20-21]。因此,本研究结果提示SHJH hr 小鼠出现的自发性心脏衰老尚处于早期,还需要进一步的观察和更多的证据。在未来研究中,应将扩大年龄范围,进一步考察SHJH hr 小鼠的心脏病理结构和衰老相关分子标志物的变化。
综上所述,本研究结果表明SHJH hr 小鼠在24周龄时心脏功能减退,心脏萎缩,SOD、GPX和CAT活性降低,8-OHdG表达升高。这些结果提示SHJH hr 小鼠可能出现了自发性心脏早衰,且与心肌组织氧化应激损伤有关。本研究将为今后针对衰老引起心脏疾病的基础研究和药物开发提供了一种非常有前景的动物模型。
[引用本文]
刘荣乐, 程灏, 尚付生, 等. SHJH hr 小鼠的心脏衰老表型研究[J]. 实验动物与比较医学, 2025, 45(1): 13-20. DOI: 10.12300/j.issn.1674-5817. 2024.100.
LIU R L, CHENG H, SHANG F S, et al. Study on cardiac aging phenotypes of SHJH hr mice[J]. Lab Anim Comp Med, 2025, 45(1): 13-20. DOI: 10.12300/j.issn.1674-5817.2024.100.
医学伦理声明
本研究涉及的所有动物实验均已通过复旦大学附属中山医院动物伦理委员会(批号:2021-05-07)和上海大学科技伦理委员会(批号:ECSHU2020-101)审查通过。所有实验过程均遵照中国实验动物相关法律法规条例要求进行。
Medical Ethics Statement
All animal experiments involved in this study have been reviewed and approved by the Animal Ethics Committee of Zhongshan Hospital Affiliated to Fudan University (Approval No. 2021-05-07) and the Ethics Committee of Shanghai University (Approval No. ECSHU2020-101). All experimental operations have been carried out in accordance with the requirements of the relevant laws and regulations on experimental animals in China.
作者贡献声明
刘荣乐负责动物实验、收集资料、数据分析及论文撰写;
程灏负责分子生物学检测,参与动物实验和病理评价实验;
尚付生参与动物实验和分子生物学实验;
常书福负责课题设计及论文修改;
徐平负责论文把关。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Autophagy and the cell biology of age-related disease
[J].
Aging impairs the neurovascular interface in the heart
[J].
Metabolic landscape in cardiac aging: insights into molecular biology and therapeutic implications
[J].
«中国心血管健康与疾病报告2022»要点解读
[J].
Interpretation of Report on Cardiovascular Health and Diseases in China 2022
[J].
啮齿类动物衰老模型研究新进展
[J].
Research progress in aging rodent models
[J].
Induction of accelerated aging in a mouse model
[J].
Small animal models of heart failure
[J].
Obtaining or generating gene mutations in mice
[J].
Mechanisms and functions of cellular senescence
[J].
Knockout mice are an important tool for human monogenic heart disease studies
[J].
Novel rhino-like SHJH hr mice with thyroid dysfunction
[J].
The accelerated aging skin in rhino-like SHJH hr mice
[J].
Hypermethylation of Bmp2 and Fgfr2 promoter regions in bone marrow mesenchymal stem cells leads to bone loss in prematurely aged mice
[J].
SHJH hr 小鼠部分生物学特性及衰老表型的测定与分析
[J].
Investigation on biological characteristics and aging phenotype of SHJH hr mice
[J].
Animal models of aging research: implications for human aging and age-related diseases
[J].
Ageing-associated phenotypes in mice
[J].
A single-cell transcriptomic atlas characterizes ageing tissues in the mouse
[J].
Mouse models of heart failure with preserved or reduced ejection fraction
[J].
The role of oxidative stress in the aging heart
[J].
Biomarkers of aging
[J].
The landscape of aging
[J].