降压物质检查是一种检查药品中降压物质是否符合规定的常见药品检验方法[1]。由动植物或者微生物发酵物中提取的药品,可能会混入使血管扩张而降低血压的活性物质(包括组胺、缓激肽等组胺类物质),中药中也可能含有未知或已知的降压成分,该类物质通过静脉注射进入人体后,有急性降血压作用,会引发严重心血管系统不良反应。因此,降压物质检查对控制药品质量、保障用药安全具有重大意义[2]。目前,包括《英国药典》[3](British Pharmacopoeia 2024)和《欧洲药典》[4](European Pharmacopoeia Supplement 11.5)等也收载了该方法,其原理与《中华人民共和国药典》(简称《中国药典》)类似,但在给药剂量和判断依据等方面存在差异。
超过质量标准规定(out of specification,OOS)是指按照实验规程操作得到不符合所建立质量标准的结果[5]。OOS分析是药品质量控制与评价的重要内容,也是实验室质量管理体系的重要组成部分。世界卫生组织(World Health Organization,WHO)以及美国食品药品监督管理局(Food and Drug Administration,FDA)、英国药品和健康产品管理局(Medicines and Healthcare Products Regulatory Agency,MHRA)等机构均发布了OOS结果调查指南等相关文件,在对FDA指导原则解读的基础上,欧美国家加大了对实验室或者工厂中遇到特定问题的研究力度[6]。国内专家学者也逐渐意识到OOS原因调查对试验异常结果分析的重要性,也有相关研究对OOS调查的作用与意义、调查分析流程等进行了探讨[7]。但国内对于OOS的重视程度仍不足,对于OOS的研究也不够全面细致,所以需要对各类OOS进行梳理总结,提高对各类试验异常结果的分析能力。
当降压物质检查出现OOS,可能是药品本身质量风险引起,也可能源于检验过程中的错误操作,因此开展OOS原因调查对于确认试验结果、评价药品质量尤为重要。其中动物实验受多种因素影响,重复性不佳,降压物质检查采用猫作为实验动物,其稳定性相对于常规实验动物更差,且手术难度大、试验流程复杂,这些因素导致调查降压物质检查出现OOS的原因难度较大。本研究团队(安全评价中心)属于四川省药品检验研究院(四川省医疗器械检测中心,四川养麝研究所),本中心承担药品(含生物制品)、医疗器械、化妆品、药包材等领域的药理毒理及相关生物学试验,是中西部药检机构中首家通过国家药品监督管理局药物非临床研究质量管理规范(Good Laboratory Practice,GLP)认证的机构。本中心已承担数十个中药及化药注射剂品种的降压物质检查标准起草和提高,年完成降压物质检验超过50批次,涉及克林霉素磷酸酯注射液、复方氨基酸(18AA)注射液、中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液等超过20个品种。结合实际工作经验和资料查阅,本文将从药品标准、人员资质、实验动物、试剂与仪器、试验操作5个方面分析这些检验工作中降压物质检查出现OOS的原因,汇总见表1。
表1 降压物质检查结果超过质量标准规定常见原因汇总表
Table 1
类别 Category | 常见问题 Common problem | 原因或解决措施 Reason or countermeasure |
|---|---|---|
药品标准 Drug standard | 标准理解有误或不透彻 | 对《中华人民共和国药典》内容进行深入理解,尤其注意不符合规定结论的判定条件;关注药品标准中给药剂量及速度 |
| 标准制定缺乏科学性或合理性 | 对标准起草资料进行核查,包括限值前研究、限值设定、验证等内容 | |
人员资质 Personnel qualifications | 试验人员资质不足 | 加强人员上岗前培训和标准操作规程培训 |
实验动物 Laboratory animal | 猫的品种 | 不同品种的猫遗传背景和生理特性存在一定的差异,对对照品或药品降压反应不完全一致。可以更换动物来源、使用实验用猫进行试验 |
| 试验过程中动物异常(呕吐、苏醒、呼吸受阻等) | 动物在试验过程中出现异常情况会影响其血压,及时清理呕吐物及呼吸道分泌物;根据动物情况考虑追加麻醉剂 | |
仪器与试剂 Instrument and reagent | 对照品不满足要求 | 确认对照品及配制后母液储存条件是否符合要求;检查对照品溶液效力是否降低;核对对照品信息(结晶水)并确认对照品配制过程的准确性 |
| 关键仪器不满足要求 | 核对生理信号采集处理系统的运行状态、日常维护与保养、性能检定是否满足试验要求、连接是否紧密有效 | |
| 试剂配制不准确 | 梳理试剂的基本信息;核对配制过程及剂量浓度 | |
| 供试品不符合需求 | 梳理供试品基本信息、确认其外观性状、调查配制过程,或重新取样复检 | |
试验操作 Testing procedure | 动物麻醉 | 查阅麻醉剂作用机制、毒性等基本信息;确认麻醉剂的浓度和剂量是否合理;注意动物麻醉防护,维持动物生理状态 |
| 动脉和静脉插管手术 | 确认动静脉插管是否渗漏;减小创口面积、避免大量出血;避免分支血管的干扰 | |
给药操作 | 注意注射给药速度及给药间隔时间保持一致,每次注射应在前一次反应恢复稳定后再进行;避免药物之间的相互作用 | |
| 数据处理 | 对照品与药品拾取的初始值和结束值标准需保持一致;注意数据修约规则 |
1 药品标准
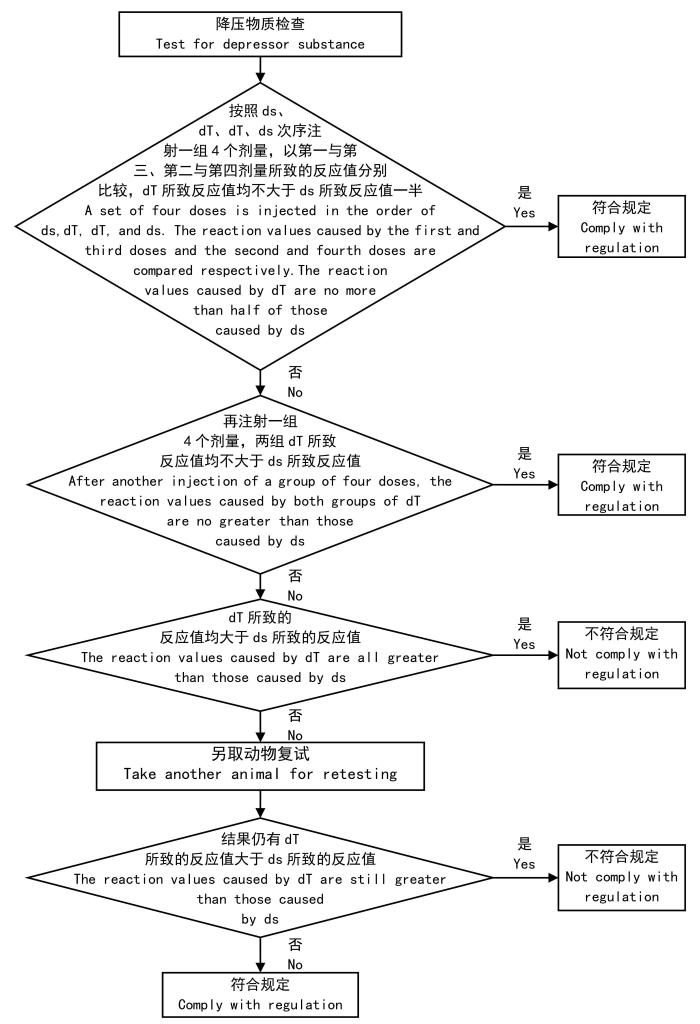
当检查结果出现OOS时,首先应对药品标准进行确认和理解,对标准理解有误或不够透彻会导致降压物质检查的结论出现偏差。
图1
图1
降压物质检查结果判断流程图
Figure 1
Flowchart for determining the results of the test for depressor substances
第二,需要关注药品标准中要求的给药剂量及速度。如某药品规定“取本品,按《中国药典》2020年版四部通则1145检查,按猫体重每1 kg缓慢注射给药1.0 mL,应符合规定。”然而,目前对于降压物质检查给药速度缺少明确的要求,“缓慢注射”缺乏明确的速度定义和依据,给药速度多由试验人员根据经验自行控制。因此,不同实验室不同试验人员对速度把握尺度不一致可能会带来试验结果的较大差异,应在标准操作规程(standard operating procedure,SOP)中对给药速度进行规定。同时,对照品和供试品需要采用相同速度进行给药,而对照品磷酸组胺引起动物降压反应为即时反应,给药速度过慢可能会引起对照品血压下降值减小,影响结果判定,且存在不同给药速度出现不同结果的可能性。总之,药品标准中要求缓慢注射的合理性和必要性都值得商榷。
第三,需参照《中国药典》2020年版四部通则9301[1]中规定的对药品降压物质检查标准起草资料进行核查,主要包括限值前研究是否充分、限值设定是否合理、是否对起草标准进行三批样品验证等内容,确认药品标准设置的科学性与合理性。
2 人员资质
因降压物质检查试验操作繁杂且难度较大,对试验人员的要求有较高的专业能力和技术水平。需要确认初检人员是否具备开展降压物质检查的能力,包括核实初检人员是否完成规定的上岗前培训、试验过程是否按照SOP进行以及初检人员是否具备检测该项目及仪器的操作技能。
3 实验动物
降压物质检查所用实验动物为猫。猫在分类学上属于动物界脊索动物门,哺乳纲,食肉目,猫科,猫属。猫用于动物实验的历史由来已久,早在19世纪末,就有科学家将猫用作生理及医药方面的研究[8]。猫血压稳定、血管壁坚韧、心搏力强,适合用于降压物质检查。《中国药典》虽明确将猫列为实验动物,但其标准化进程在国内推进缓慢。目前尚未正式发布实验猫的国家标准,仅有河北、黑龙江、吉林、四川、山西、湖北、广东等省份制定了地方标准,但各地方标准的不统一造成实验动物的质量差异较大,可能成为降压物质检查结果偏差的主要原因。
按《中国药典》规定,降压物质检查用猫应符合:健康合格,体重2 kg以上;若为雌性应为非妊娠期。应核实猫在饲养期间的房间环境是否符合要求,温度需保持在20~26 ℃,相对湿度为30%~70%。猫对营养的需求较高,尤其是处于生长期的猫需要优质且足量的蛋白质。除此以外,猫还存在无法将β-胡萝卜素转化成维生素A和食用未糊化的淀粉可能引起腹泻等生理特点。因此,猫粮中应含有足够蛋白质、脂肪、矿物质、维生素和碳水化合物,保证猫有足够的营养来源。若发现动物在检疫和适应环境期间出现腹泻、体重降幅超过20%、感染猫瘟或其他传染疾病等情况,其健康状态已无法满足降压试验要求,不应纳入试验。
猫在试验过程中出现的一些异常情况可能影响到试验结果。常见的有:(1)每次试验前,应对动物进行禁食不禁水处理。若麻醉前未进行有效禁食,猫在试验过程中可能出现呕吐,引起血压值波动。试验过程中应及时清理动物呕吐物,防止呕吐物进入气管引起窒息。(2)试验过程中动物苏醒挣扎,导致血压出现异常波动。应根据动物状态判断是否追加适量麻醉剂,但给予麻醉剂可能会引起动物血压变化,影响结果判断。若需要追加麻醉剂,应避开试验药品给药期间,追加麻醉剂后应等待动物血压充分恢复后再进行给药,必要时再次进行灵敏度考察。(3)动物呼吸道分泌物较多,堵塞气管,导致动物呼吸受阻,血压波动幅度增加。应及时清理分泌物,必要时可以在手术时给予适量抗胆碱药抑制呼吸道分泌黏液,保持呼吸道通畅。(4)动物给药剂量过大,出现大、小便失禁等异常情况,且血压值大幅降低时,应立即停止试验,并根据动物状态实施安乐死或进行救治。
4 仪器与试剂
4.1 磷酸组胺对照品
判定供试品降压物质检查是否符合规定是通过比较供试品与对照品引起动物降压反应值,因此对照品也是调查降压物质检查出现OOS原因的重点方面。
降压物质检查使用到的对照品为磷酸组胺,该对照品来源于中国食品药品检定研究院(简称中检院),CAS号为51-74-1,每支20 mg,储存条件为遮光保存,并置于2~8 ℃的环境中。精密称取磷酸组胺对照品适量,按组胺计算,加水溶解成每1 mL中含1.0 mg的溶液,分装于适宜的容器内,于4~8 ℃下贮存,经验证,溶液中的组胺在保持活性、符合要求的条件下,可在3个月内使用。临用时,用0.9%氯化钠溶液稀释成所需浓度的溶液。
应确认试验中使用的对照品溶液是否存在异常,如对照品及配制后母液的储存条件是否符合要求,储存期间是否存在温度超标及长时间暴露在强光下等异常情况。检查对照品溶液在3个月内效力是否降低,每次试验灵敏度是否符合要求,引起动物血压下降值是否与之前试验有明显不同。同时,还需确认对照品配制过程的准确性,特别需注意中检院不同批次的磷酸组胺对照品可能带有结晶水导致分子量不同,进而换算系数不同。因此,试验前需要核对中检院官网提供的对应批号对照品的信息。例如,批号为150510-202214的对照品分子式为C5H9N3·2H3PO4,相对分子质量为307.14,换算系数为0.36;而批号为150510-201313的对照品分子式为C5H9N3·2H3PO4·H2O,相对分子质量为325.15,换算系数为0.34。溶解稀释步骤的计算公式及计算数值也需要再次核对。除此以外,还需确认配制过程中用到的电子天平、移液器及容量瓶等是否进行了检定、校准或标化,且满足试验需求。
4.2 仪器
降压物质检查用到的主要仪器为生理信号采集处理系统。首先,需核对仪器的运行状态是否正常、是否进行日常维护与保养、确认性能是否满足试验要求等,特别需要关注所使用的生理信号采集处理系统通道及传感器是否通过校准,校准的误差范围是否满足试验要求,是否进行仪器期间核查及日常校验,尤其是出现临界值时。其次,应检查仪器本次使用运行状态、仪器最近使用运行状态是否异常。若条件允许,立即对试验仪器进行校验,确认其运行状态。也可以更换生理信号采集处理系统传感器和信号通道进行试验,以排除不同传感器和信号通道带来的影响。最后,确认仪器连接状态,尤其在试验过程中出现血压信号时断时续、血压差突然变小等情况时,需确认包括传感器与信号放大系统以及电脑与信号采集处理系统之间的连接是否稳固通畅。
4.3 试剂
降压物质检查用到的主要试剂有:灭菌注射用水、0.9%氯化钠注射液、肝素钠注射液、麻醉剂等。灭菌注射用水用于溶解对照品;0.9%氯化钠注射液用于对照品、供试品和肝素钠注射液的稀释,每次给药后需立即注射一定量的0.9%氯化钠注射液,以确保供试品或对照品溶液完全进入血液循环;肝素钠注射液用于抗凝;麻醉剂用于术前动物的麻醉。首先,梳理试验中使用到试剂的基本信息,包括试剂名称、来源、批号、生产日期、有效期、储存条件、使用方法等,确认试剂是否符合试验要求。其次,确认麻醉剂以及肝素钠注射剂的配制过程以及给药剂量是否准确合理。如肝素钠注射液的常用配制浓度为200~1 000 U/mL,注射体积通常为1 mL,若给药剂量过大,可能会影响心脏射血功能进而影响血压值;若给药剂量太少则抗凝效果不佳,可能引起血液在管路中流动性降低甚至凝结,从而导致血压差值减小或血压值降低。麻醉剂乌拉坦在配制过程中体积会有较大变化,因此必须使用容量瓶进行定容,否则会使麻醉剂浓度不准确,导致麻醉效果不佳。除此之外,麻醉剂的配制过程会涉及称量、溶解、稀释等操作,需要对溶解稀释步骤的计算公式及计算数值再次核对,并确认配制过程中使用的电子天平、移液器以及容量瓶等是否进行检定、校准或标化,并满足试验需求。另外需要注意,乌拉坦虽然是《中国药典》推荐用麻醉剂,但具有一定的致癌和致畸性,配制时应在通风橱中进行,并且重视实验操作人员的个人防护。
4.4 供试品
目前需要进行降压物质检查的品种主要包括:大输液剂[如复方氨基酸(15)双肽(2)注射液、鱼油脂肪乳注射液等]、化学药物注射剂(如克林霉素磷酸酯注射液、注射用盐酸表柔比星等)、原料药等。首先,应核查供试品的基本信息,至少包括供试品名称、来源、有效期、批号、规格及储存条件等,确认供试品是否在有效期内、储存条件是否合理,确保供试品信息无误。其次,核查供试品外观性状是否稳定、内外包装是否破损、三腔袋使用前是否混匀,确保供试品的稳定性;核查供试品取样量是否满足要求、供试品配制方法是否合理、配制过程中使用的电子天平、移液器以及容量瓶等是否进行检定、校准或标化,并满足试验需求;确定供试品给药剂量、体积以及浓度准确。最后,可对供试品理化性质进行检测来确认供试品质量,或重新取样复检。
5 试验操作
降压物质检查的主要操作步骤有:动物麻醉-进行颈动脉插管及股静脉插管手术-注入抗凝剂-打开检测仪器,记录血压-灵敏度检测-依次注入供试品及对照品进行检测-处理、分析数据。由于降压物质检查试验操作细节纷繁且难以回忆溯源,每次试验的操作无法完全复刻,因此,对此部分的原因分析排查难度较大。为改善此情况,可以通过完善细化SOP,加强人员上岗前培训,以确保试验人员操作的准确性及稳定性。在出现OOS后,可选择经验更加丰富的试验人员,并在操作过程进行双人复核来减少试验操作带来的干扰。
5.1 动物麻醉
《中国药典》推荐将巴比妥类作为降压物质检查用动物麻醉剂,也可以使用尿烷(乌拉坦)或异氟烷呼吸麻醉等其他麻醉剂。实验动物的麻醉效果是影响试验的因素之一,也是试验顺利进行的关键。
首先,应查阅不同麻醉剂对猫麻醉效果的资料,麻醉剂麻醉维持时间要满足试验要求,减少中间追加而导致麻醉不稳定,影响试验进程。了解麻醉剂麻醉机理或毒性及不良反应是否会引起动物血压异常,是否会与对照品或者供试品发生反应影响试验结果可靠性。如使用舒泰麻醉猫时,被麻醉猫呈熟睡状态,肌肉松弛作用好,止痛效果强,苏醒快,不抑制呼吸,不引起癫痫,但是会暂时引起动物体温下降[11];丙泊酚起效迅速、可控性强、作用时间短、清醒快而完全、不良反应少,是较理想的烷基酚类催眠性静脉全身麻醉药,在临床应用广泛[12]。乌拉坦麻醉猫常用剂量为1 g/kg,对神经传递的影响较小,且一次注射后可以维持较长时间的稳定麻醉(6~10 h),麻醉过程中对心肺系统的影响也很小,但乌拉坦为强致癌物质,还会使心电活动周期中各波时间和各间期延长,从而引起心率减慢,对血压和血糖都有一定影响[13];比索洛尔或美托洛尔等β受体阻滞剂与利多卡因、布比卡因合用后会导致后者清除率降低,多次给药会有药物蓄积的风险[14];吸入性麻醉药合用后易致心动过缓、血压明显降低[15]。同时也有研究提出采用速眠新与戊巴比妥钠的复合麻醉方法,利用药物之间的相加或协同作用,不仅减少了药物的不良反应和麻醉意外,还减少了用药剂量,而且安全、高效,该复合麻醉方法是供试品降压物质检查试验中较为理想的猫麻醉方法[16]。
其次,考虑麻醉剂的浓度和剂量是否合理,不同的麻醉剂量或浓度会明显影响动物麻醉状态,对血压值以及血压稳定性也有较大影响。目前,本中心实验室常用于猫的麻醉剂有戊巴比妥钠和尿烷,其中戊巴比妥钠的浓度为45 mg/mL、剂量约50 mg/kg,尿烷浓度为0.4 g/mL、剂量约1.0 g/kg。另外,还需注意常备一些如肾上腺素等用于麻醉过量的急救药。不同实验室选择的麻醉剂种类、浓度、剂量、给药操作等都会有一定差别,麻醉操作需要不断积累经验。
最后,麻醉防护对于维持动物正常麻醉状态也非常关键,在进行麻醉前需提前预热实验台,控制温度在35 ℃左右,防止试验过程中动物失温。若试验过程中手术台温度过高同样可能会导致猫提前苏醒,引起其血压波动。
5.2 动脉和静脉插管手术
降压物质检查试验猫手术时,需在一侧颈动脉插入连接测压计的动脉套管,管内充满适宜的抗凝剂溶液,以记录血压;在一侧股静脉内插入静脉插管,供注射药液用。
首先,确认管道是否渗漏。其中,动脉血压较高,若管道通路出现渗漏,血液会快速回流到管道甚至三通阀处,需要检查管道各个连接处是否紧密以及动脉血管结扎线是否系紧,确认出现渗漏原因后,针对性地更换动脉插管或对管路进行密封补救处理。静脉血管可以推入一定量的生理盐水,若阻力较大、有液体渗出或者注射部位有鼓包,即确认静脉插管通路有渗漏。确认静脉插管有渗漏后,应进一步分离静脉血管排查渗漏点,根据情况判断是否需要换一侧静脉血管再次插管,或是结扎血管并在近心端进行再次插管。
其次,还应核实分离动脉血管和静脉血管操作是否影响动物状态。分离血管时需采用钝性分离,尽量减小创口面积,过程中避免大量出血影响动物血压。分离过程中,还需注意血管周围散在的神经,减少手术器械触碰,减少对神经造成的损伤。
最后,动脉血管和静脉血管周围常存在一些分支血管,应确认这些血管是否会影响动物血压值以及给药准确性。动脉血管上若有较大分支血管可能会引起插管时出血,应在进行插管前将其结扎,阻断其与颈动脉的连接;若血管长度允许,尽量将动脉血管远心端结扎位置选在该分支血管之前,减小动脉分支血管对动物血压的影响。若静脉周围存在分支血管可能会导致给药后血压反应值不准确,可以通过结扎分支血管或者调整插管位置来减少分支血管的干扰。
5.3 给药操作
全部手术完毕后,将测压计调节到与动物血压相当的高度(一般为1.3~20.0 kPa),开启动脉夹,待血压稳定后即可进行药液注射。首先,给药过程中需保持注射速度一致,降压反应是即时反应,若无给药速度要求,每次给药操作尽量都在5 s内完成。每次注射后立即注入一定量(0.5~1.0 mL)的0.9%氯化钠注射液,确保给药剂量准确;相邻两次注射的间隔时间应保持固定(3~5 min),每次注射应在前一次反应恢复稳定后再进行。此外,注射剂量一般为0.2~1.0 mL/kg,样品和对照品注射体积应保持一致。同时,受制于猫的血容量约占其体重的5%~9%,对于体重为4.5 kg的猫,其血液总量大约在225~405 mL,给药剂量不能过大。其次,建议在考察不同品种供试品之前都进行灵敏度检查,这样可以排除上一种药物对对照品灵敏度的影响。也可在试验给药结束后,再进行一组灵敏度考察,避免试验后期动物对对照品的灵敏度下降而出现异常值,尤其是给药剂量较大的时候。最后,应查询药品包括理化性质(分子量、酸碱性、溶解性等)、药理作用及其作用机制、毒性及不良反应以及可能存在的药物相互作用等基本信息。
5.4 数据处理
试验结束后对原始数据进行处理,比较供试品和对照品引起的降压反应值大小,得出实验结论。不同实验室使用的采集系统型号不尽相同,数据处理的方法与标准也存在差异,实验室应建立符合需求的数据处理SOP。数据处理需要注意降压反应中对照品与供试品选取的初始值和结束值标准是否一致,初始值应统一选取在给药前血压平稳处,结束值应选取在给药后血压下降最低点处。其次,需注意对照品1/2值计算过程中采用的数据数值修约规则。《中国药典》对数据修约主要遵循GB/T 8170—2008《数值修约规则与极限数值的表示和判定》[17],采用“四舍六入五考虑”的原则。
6 讨论
OOS分析和评估能力是衡量实验室质量管理水平的重要指标。对于药品检验机构而言,通过分析OOS,可以排除非受试药物本身质量导致OOS的主要原因,发现实验室在人员资质、仪器与受试物管理能力中可能存在缺陷,从而提高实验室检验质量及异常问题的处理能力。药品安全性检查大多涉及动物实验,其不确定性大、影响因素多、重现性较差,OOS调查过程具有复杂性。降压物质检查作为药品安全性检查的重要组成部分,目前仍存在实验动物质量不稳定、试验操作复杂、对于临界供试品的检查和判断方法欠妥等不足之处。近年也有一些研究关注采用“组胺类物质检查法”、体外离体器官试验法以及理化检测方法来替代降压物质检查法,但是具有降压作用的物质比较复杂,大多含量极微,单独采用理化方法进行分析难度较大或不够全面;而“组胺类物质检查法”测定药品中组胺类物质的限量采用的是离体器官[20],干扰因素较多,特别是一些组成较为复杂的制剂。因此,采用猫进行降压物质检查在目前仍然是药品安全性检查中不可或缺的方法。
为减少OOS的发生,实验室应加强人员培训,确保试验人员充分理解检验方法,针对人为因素进行调整和改善,减少人为失误;加强对供试品、对照品及试剂的管理,确保试验物质的可靠性和稳定性;完善仪器校准和维护流程,确保仪器运行状态正常;完善管理文件,定期对国内外药典、行业标准、SOP进行梳理,对易错或更新的部分,增加举例与解释,并在培训时重点说明;建立实验室质量台账,定期审核和改进实验室操作流程,及时发现并改进存在的问题,确保实验室操作的稳定性和准确性。定期对实验室OOS进行分析总结,包括OOS内容、发生原因、解决措施及可能暴露的风险等。通过以上措施,可以有效降低实验室OOS的发生率,提升实验室的检测能力和质量管理体系的稳定性。一旦出现OOS,需要及时针对检验全过程开展全面、准确、有效的调查,以确保检验结果准确可靠,或者发现药品可能存在的一些安全性风险。
本文虽较为详细地阐述了降压物质检查出现不合格或异常结果等OOS的主要原因及解决措施,但仍缺乏充足的试验数据支撑,且部分内容是依据本实验室的工作经验或文献资料,未经过多个实验室比较验证,还需进一步确认其适用性。
[引用本文]
童希洋, 阙昌田, 张峰, 等. 降压物质检查结果超过质量标准规定的常见 原 因 分 析[J]. 实 验 动 物 与 比 较 医 学, 2025, 45(3): 331-339. DOI:10.12300/j.issn.1674-5817.2024.143.
TONG X Y, QUE C T, ZHANG F, et al. Analysis of common causesof out-of-specification results in the test for depressor substances[J]. Lab Anim Comp Med, 2025, 45(3): 331-339. DOI: 10.12300/j.issn.1674-5817.2024.143.
作者贡献声明
童希洋负责实施整个项目、通过文献检索调查国内外降压物质研究及OOS研究现状、撰写及修改文章;
阙昌田负责整理和分析本单位的降压物质检查试验原始数据;
张峰负责核对文章格式;
赵璐负责修订文章和提供专业知识咨询;
王红平负责策划项目。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
探讨药品质量控制过程中OOS分析存在的问题
[J].
On problems of OOS investigations in pharmaceutical quality control
[J].
实验用猫繁育与应用相关数据的检测分析
[J].
Analysis of breeding and application data for laboratory cats
[J].
环境丰富对英国短毛猫应激相关指标的改善作用
[J].
Improving effect of environmental enrichment on stress-related indicators of British-shorthair cats
[J].
实验用猫的应用及标准化
[J].
Application and standardization of laboratory cats
[J].
野生猫科动物复合麻醉的探究
[J].
A research of combined anesthesia in wild felids
[J].
Deep reinforcement learning-based propofol infusion control for anesthesia: a feasibility study with a 3000-subject dataset
[J].
清醒猫与乌拉坦麻醉猫的心电图比较
[J].
Comparison of ECG between awake cats and urethane anesthetized cats
[J].
麻醉中药物的相互作用
[J].
On the interactions between drugs during anesthesia
[J].
宠物手术的吸入麻醉流程及注意事项
[J].
Inhalation anesthesia procedure and precautions for pet surgery
[J].
降压物质检查中家猫的麻醉方法初探
[J].
A primary study of anesthesia in domestic cats during testing of antihypertensive substances
[J].
药品检验机构不合格结果调查的实践与探讨
[J].
Practice and discussion of out-of-specification result investigation in institutes for drug control
[J].
基于WHO疫苗国家监管体系评估等标准和指南要求对OOS分析工作的思考
[J].
Consideration on OOS analysis work based on the requirements of WHO benchmarking of the assessment of the national regulatory authority for vaccines
[J].
离体豚鼠回肠法应用于骨肽类注射剂中组胺类物质检测
[J].
Application of isolated guinea pig lleum method for detection of histamine substances in osteopeptide injections
[J].