动物实验是生物医学研究和药物研发过程中举足轻重的一环,被广泛用于疾病发生发展机制探索以及药物疗效和安全性评估。然而,随着疾病机制研究不断深入、药物研发周期需要缩短、研发成本控制要求提高,以及动物实验伦理福利合规性要求日益严格,动物实验面临的挑战也越来越多。其中,最为根本的制约因素是实验动物与人类在生物学层面存在的种属差异所导致的低相似性,这使得动物实验结果在向人类临床转化时存在显著的预测偏差,同时也是药物临床试验失败率高的原因之一。此外,随着公众对动物福利的关注度提高,动物实验的伦理合法性也引发争议[1]。尽管实验动物福利状况的改善能提高研究结果的可靠性[2],但日益严格的伦理审查制度仍让研究者在设计和实施动物实验时付出了更多时间和经济成本。
为了应对动物实验所面临的这些挑战,2022年9月美国参议院通过了食品药品监督管理局(Food and Drug Administration,FDA)现代化法案2.0,允许包括生物3D打印模型在内的其他非临床试验方法纳入药物批准流程。2025年4月,FDA发布新公告,提出将在单克隆抗体等药物研发中逐步取消动物试验,转而采用人工智能计算模型、类器官毒性测试、3D微生理系统等一系列“新的替代方法”以获得更准确、可靠且与临床试验相匹配的能够证明安全性和有效性的数据。其中,生物 3D 打印模型具有高仿生、高异质性和高通量等特征,不仅能够模拟真实生理环境[3],提高实验的准确性和可重复性,还能显著减少动物使用数量,符合伦理要求,因此成为动物实验替代方法中的典例。
相较于其他非临床模型,生物3D打印是用各种细胞和材料快速、有效、高精度地建立人体相似组织和器官,展现出能够准确模拟患者治疗反应的潜力[3]。生物3D打印技术作为一种前沿的增材制造方法,其核心优势在于精确构建具备特定生物学功能的复杂3D组织结构, 因此可用于高度仿生性的疾病建模和药理毒理器官建模,以实现高通量药物筛选和药物毒性评估,且具有对受损人体组织的有效模拟、功能性修复或替代性重构的潜在应用价值。与此同时,动物实验仍然是药物研发中的关键一环,生物3D打印与动物实验的联合应用能够将二者的优势结合,更为全面有效地模拟人体内的复杂生物学过程,从而在疾病机制、精准医疗等方面取得研究突破。本文将系统介绍生物3D打印技术,以及生物3D打印模型在药物研发与组织工程领域的研究进展,并探讨其与动物模型等其他非临床模型的交叉应用及未来前景,以期为生物医药研究和发展提供参考。
1 生物3D打印技术
3D打印采用生物材料作为非临床模型中细胞生长和分化的支撑结构,对打印组织的结构和功能起重要作用。选择生物打印材料时,需重点考虑其生物相容性、降解性、力学性能、可打印性和生物活性等因素。打印技术结合计算机辅助设计可确保模型的高精度和高可控性,实现模型尺寸、结构和细胞组成的标准化,降低了个体差异带来的影响[6],提升了实验结果的可重复性和可靠性。批量化生产的3D打印模型也有效减少了重复实验的时间成本。因此,生物材料和打印技术不仅是生物3D打印的核心要素,而且指引着该领域的主要发展方向。
1.1 生物材料
根据来源不同,生物材料可划分为天然生物材料与合成生物材料[7]。天然生物材料如脱细胞外基质(decellularized extracellular matrix,dECM),具有优良的生物相容性和生物活性,在生物3D打印中广泛应用。为提升材料的结构稳定性,还可将dECM与其他材料混合,制备力学性能增强的复合材料。合成生物材料的结构明确性高,性能可控性强,但由于缺乏天然细胞外基质(extracellular matrix, ECM)成分,难以调控细胞的生物化学信号转导,进而影响细胞在材料表面的附着、增殖与分化等行为,因此通常需要对合成材料进行修饰,以优化材料与细胞的相互作用。
选择合适的生物材料需要考虑多种因素,包括打印技术的适配性、目标组织的特异性、所模拟生物过程的复杂性等。未来还需研发具有可调节性的生物材料,实现在力学性能、化学性质和生物学特性上的精确调控,从而准确复现目标组织的蛋白质组成和天然ECM环境,以构建适用于生物医药研究的体外组织模型。
1.2 主要打印技术
图1
图1
3种生物3D打印工艺类型的工作机制示意图
Figure 1
Schematic diagram of the working principles of three types of 3D bioprinting processes
1.2.1 喷墨式生物3D打印
喷墨式生物3D打印技术是传统台式喷墨打印的改良版,通过精确控制液滴的喷射以构建复杂组织结构,包括热泡、压电和电磁等多种打印方式。该技术操作流程简易,成本低,但其发展仍面临诸多挑战,包括材料限制、喷嘴堵塞、打印速度慢,以及高剪切应力造成的细胞损伤等。因此,优化喷嘴设计、墨水配方和打印技术是关键。其中,多材料多喷嘴系统的研发以及液滴控制技术的进步,为打印异质组织结构和高分辨率复杂模型提供了可能。同时,信息技术的深度融合,特别是实时反馈和监控系统的集成应用,显著提升了打印过程的稳定性和精密度。
1.2.2 挤出式生物3D打印
1.2.3 光固化生物3D打印
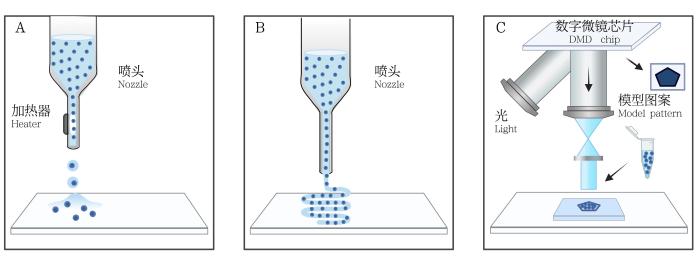
光固化生物3D打印技术根据制造工艺分为扫描式和投影式两大类型。以数字光处理(digital light processing,DLP)打印技术为例[9],通过数字微镜芯片和精密运动控制系统进行快速投影,可以构建毫米级分辨率的生物3D结构。该技术的低剪切应力特性有利于维持细胞活力,高分辨率又适用于构建复杂细胞结构。因此,光固化打印的研究聚焦于提高光固化打印适用性,包括材料拓展、技术融合及多生物墨水共打印。此外,人工智能(artificial intelligence,AI)引入可实时调节打印过程,并增强光固化生物3D打印在组织工程中的应用潜力。
2 生物3D打印模型的药物研发应用
尽管药物的研发投资持续增加,但根据FDA公开发表的新药批准条目,2021—2025年间新药获批数量并未显著上升[11]。药物研发时间长、过程复杂、成本高昂,涵盖药物发现、临床前验证和临床试验等多个阶段。当前,药物研发面临的一大挑战是非临床模型预测效力不足。据报道,约40%的新药在通过动物模型的临床前验证后,仍会在临床试验阶段遭遇失败[12],说明传统的药物研发方法可能存在一定局限性。此外,临床试验失败往往归因于患者个体间的异质性,这一特质难以通过传统非临床模型有效评估。因此,个性化医疗和相应的药物筛选方法逐渐成为研究热点[13]。生物3D打印在药理学研究,尤其是药物筛选、药代动力学和药理学分析方面,具有其独特优势,因此在近年来得到快速发展。
生物3D打印模型用于药物研发的优势主要体现在两个方面:一是通过精准调控细胞与细胞、细胞与基质的组合,构建具有高仿生性的疾病模型,为药物筛选和评估提供精确平台;二是利用生物3D打印技术构建具有特定功能的器官模型,以评估药物的治疗效果及潜在毒性。
2.1 疾病模型
2.1.1 肿瘤模型
在生物3D打印肿瘤模型中,共打印内皮细胞与肿瘤细胞,以研究肿瘤侵袭、迁移和血管新生过程。成纤维细胞作为肿瘤微环境中的关键基质细胞,则常被用于研究ECM重塑。此外,免疫细胞的引入对于提高模型完整性、生理活性和临床相关性同样至关重要。
Tung等[14]基于生物3D打印技术,构建了整合神经血管单元(neurovascular unit,NVU)的患者源性胶质母细胞瘤(glioblastoma,GBM)模型,包括微血管内皮细胞。该模型与3D单一培养物和2D单一培养物的转录组学数据的比较结果显示,整合NVU的3D-GBM模型的糖酵解、细胞因子信号、血管生成相关基因表达上调,表明该模型具有高度的临床相似性。药物筛选结果表明,测试的多数化合物表现出更有效地破坏肿瘤血管系统的作用,而非直接抑制肿瘤细胞增殖,提示此类药物的临床效果可能主要通过阻断肿瘤血液供应来实现。
Desigaux等[15]共打印内皮细胞、肿瘤相关成纤维细胞(tumor-associated fibroblast,CAF)和肿瘤细胞,以深入研究CAF在肿瘤发生发展进程中的生物学功能。发现CAF不仅参与微血管调节,同时对ECM的重塑也具有显著性影响。模型中富含CAF的基质区域显示出更高的杨氏模量(又称拉伸模量),平均测量值分别约为71 kPa和27 kPa。
Tang等[16]将巨噬细胞整合到由患者来源的GBM干细胞、星形胶质细胞和神经干细胞构成的生物3D打印GBM模型中,观察到巨噬细胞的加入导致模型表现出恶性程度更高的间充质亚型GBM特征,且巨噬细胞优先向M2表型极化;这一现象与GBM中巨噬细胞的极化特征吻合。他们先前的研究结果表明,高硬度的生物3D打印GBM模型在分子水平上表现出间充质亚型GBM的特征,并对标准嵌合抗原受体(chimeric antigen receptor,CAR)-T细胞疗法表现出耐药性;这与在实体瘤中观察到的现象相似[17]。在此基础上,该团队研究发现,ECM硬度增加可显著抑制CAR-T细胞渗透和肿瘤细胞杀伤功能,由此开发了一种创新的热诱导型 CAR-T细胞疗法,以应对高硬度ECM带来的GBM治疗挑战。随后,该团队还进一步将CAR-T细胞整合到具有不同硬度的生物3D打印胶质瘤模型中,以探究生物物理因素对CAR-T细胞治疗的影响[18]。这些结果共同说明,除了表征肿瘤细胞的免疫反应之外,免疫细胞的引入对于用生物3D打印模型研究生物治疗或抗肿瘤药物的免疫耐受机制至关重要。
2.1.2 传染病模型
在传染病研究领域,体外组织模型的应用尚处于起步阶段,但生物3D打印技术已经展现出不容忽视的研究价值与应用潜力。该技术能够构建与外来物质接触的复杂组织模型,包括皮肤、角膜和脉管模型。这些模型在微观结构和生理功能层面均显示出与天然组织的高度相似性,在评估病原体直接感染、组织屏障功能以及治疗效果测试方面具有重要作用。此外,生物3D打印技术可灌注血管网络,为研究感染细胞或病原体穿过组织屏障后在体内传播的机制提供了实验平台,并能够模拟感染诱导的细胞因子变化过程,以探究这一过程对循环系统的潜在影响。
Johnson等[19]应用生物3D打印技术开发了一种神经系统芯片,旨在研究神经系统中的病毒感染过程。该芯片上有3个腔室:(1) 包含海马神经元的中枢神经系统腔室;(2) 包含颈上神经节神经元的周围神经系统(peripheral nervous system,PNS)腔室;(3) 包含神经膜细胞和上皮细胞的周围神经成分腔室。为了解神经系统中的病毒感染和转运过程,以开发各种神经系统疾病治疗方案,研究人员使用伪狂犬病毒作为病毒检测实验对象。该病毒被改造为在发生单一病毒颗粒感染时表达原色,在多于一个病毒颗粒感染时颜色发生改变。研究发现,伪狂犬病毒在PNS室的轴突网络中运输,从而感染腔室中的外周神经元细胞。而病毒颗粒在向其他区域的传播中受到了限制,神经膜细胞和海马神经元中仅表现出单一原色,而非预期中的多色表达。这表明尽管PNS腔室中神经元的直接感染确实导致了病毒颗粒传播到海马神经元和神经膜细胞,但可能还存在限制细胞被多个或多次病毒感染的细胞因子。除了有助于研究神经系统中病毒感染机制和屏障外,该神经系统芯片还为病毒学、分子生物学和神经科学分析提供了一个灵活的生理平台,适用于分析局部扰动(如药物、病原体、电/机械能等)在神经系统层面的影响。
2.1.3 罕见病模型
在罕见病研究中,鉴于其发病率低和治愈难度高,开发精准疾病模型以解析发病机制显得尤为关键。生物3D打印模型在罕见病模型构建上具有独特优势,能通过整合多能干细胞、生长因子和3D培养环境实现对培养干细胞的有效分化。
Banerjee等[20]首次应用抽吸辅助自由形态生物打印技术,成功创建了人类戈谢病(Gaucher disease,一种罕见的常染色体隐性遗传病,临床表现神经功能障碍、骨坏死和畸形、肝脾大和脾功能亢进等)3D离体模型。这种技术不同于主流的喷墨式、挤出式和光固化生物3D打印,是通过抽吸作用,实现对生物墨水的挤出量和速度的精确控制及精准释放,在进行无支架打印或需要精准定位时更具有优势。该研究将人骨髓间充质干细胞和不同严重程度的戈谢病患者的外周血单核细胞共培养,形成球状体,借助抽吸辅助自由形态生物打印技术,精准吸取单个球体,依次放置在应力凝胶中,实现球体的相互靠近和自组装。这一过程不仅模拟了骨骼发育进展,还实现了打印后的组织构建。这种3D打印戈谢病模型具备适应个性化医疗的潜力,不仅有助于研究戈谢病的病理生理机制,还适用于个性化药物筛选和开发。此外,尽管生物3D打印技术用于退行性神经疾病建模时受到一定限制(神经细胞的高敏感性和脆弱性会导致生物墨水制作困难,逐层打印过程中结构容易塌陷),但在脊髓或脑样结构模型构建时展现出一定潜力。已有研究采用生物3D打印技术制备了一种水凝胶载体[21],以探究肌萎缩性侧索硬化症(amyotrophic lateral sclerosis,一种以大脑皮质锥体细胞、脑干运动神经核和脊髓前角细胞同时受累为特征的运动神经元病,俗称渐冻症)患者来源的干细胞分化过程以及电生理特征。这种用患者来源细胞制成的3D打印结构可能是用于研究肌萎缩性侧索硬化症的潜在模型。
2.2 药物毒性评估模型
2.2.1 肝脏模型
肝毒性的低预测性是导致药物在临床试验过程中失效的原因之一。例如,2型糖尿病治疗药物Fasiglifam (TAK-875)因具有药物诱导性肝损伤(drug-induced liver injury,DILI)[22]而未能成功上市。但在临床前动物实验、早期人体临床试验与Ⅲ期临床试验的对比结果中,DILI的检测并不总是呈现一致性。这不仅增加了临床试验受试者潜在的肝毒性风险,也大幅增加了药物开发流程中的经济与时间成本。因此,开发以个性化细胞类型为基础的高效的体外肝脏模型,已被视为一种具有潜力的解决策略。
近年来,生物3D打印肝脏模型已经取得了重大进展。据Ali等[23]的调查报告,生物打印肝脏模型在药物毒性实验中的应用占比高达41%,这与肝脏具有的外源代谢和解毒功能,以及药物研发对肝毒性预测的需求一致。例如,基于原代人肝细胞、肝星状细胞和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)构建的生物3D打印人肝脏模型,用曲伐沙星(一种无法通过细胞模型评估肝毒性的药物)处理标准2D培养物和3D打印物,毒性检测结果表明:即使在亚微摩尔剂量下,3D打印物经曲伐沙星干预后对白蛋白表达的抑制作用也大于50%;相比之下,暴露于相同治疗条件和时间进程的标准2D培养仅在测试的最高剂量下显示出曲伐沙星毒性,说明3D打印肝组织在预测临床肝毒性方面具有显著优势[24]。后续研究在肝细胞类型及打印结构上进行多样性优化,将肝细胞来源从原代肝细胞拓展至人类诱导多能干细胞和人脂肪间充质干细胞,并设计了一个肝小叶状的三维结构,通过在不同的水平和垂直方向上交替打印,可促进肝细胞和肝星状细胞、HUVECs之间的旁分泌信号传导[25-26]。2024年,Dey等[27]首次开发出血管化生物3D打印肝腺泡模型,该模型采用猪dECM作为生物打印材料,结合微流控系统,维持细胞长期活性和功能。在静态模型和微流控模型中研究非肝毒性、肝毒性和特异性药物,通过测定3种药物治疗后肝细胞的总DNA浓度、乳酸脱氢酶活性和细胞色素P450还原酶活性反应,评估两种模型的差异性和生理相关性。结果显示,微流控模型在特异性和肝毒性药物的肝毒性反应方面表现出更高的敏感性,24 h和72 h时的半数有效浓度(median effective concentration,EC50)和细胞内乳酸脱氢酶活性均显著低于静态模型,从而证实了人体对于不同药物的特异性反应。
2.2.2 心脏模型
原代人类心肌细胞在体外培养条件下增殖能力受限,同时心肌细胞的获取又高度依赖于心脏组织活检,这进一步限制所获得的原代心肌细胞量。因此,为了满足构建生物3D打印心脏模型的需求,通过诱导多能干细胞(induced pluripotent stem cells,iPSCs)定向分化获得的心肌细胞成为生物3D打印心脏模型的主要来源。Arai等[30]采用人iPSCs来源的心肌细胞进行生物3D打印,成功构建了无支架的3D心脏模型,并通过建立能够模拟人类心脏收缩功能的分析系统,评估药物治疗对心脏结构的潜在毒性影响。此外,以支架为基础的生物3D打印心脏模型在药物毒性评估研究中也极为常见。Iwanaga等[31]采用明胶和海藻酸盐的复合物作为打印材料,制备了脱细胞支架,然后在支架上种植心肌细胞,形成了具有动态搏动能力的预组织结构;在肾上腺素负荷试验中,预组织结构搏动率的显著提升验证了心肌细胞对药物的反应性以及该3D打印心肌组织的成熟度。
为满足心脏离体模型构建对心肌组织工程化制造和实时监测集成的双重需求,生物3D打印技术和器官芯片技术的结合已成为一种解决方案。Liu等[32]提出了一种创新性技术路线,将生物3D打印技术和静电纺丝技术有机结合,用于制造体外3D工程化心脏组织,并将其集成至微流控芯片中,构建出用于药物研究的心脏芯片内模型。该方法通过生物3D打印技术制备微米级支架框架,随后采用静电纺丝在支架表面涂覆纳米纤维网络,模拟ECM微环境,指导心肌细胞排列,促进信号传递和收缩。使用心脏毒性化疗药物多柔比星(doxorubicin,DOX)和心脏毒性保护剂得拉唑沙(dexrazoxane,DEX)对该模型进行药物性心脏毒性评估,结果表明:芯片中单DOX组的心肌细胞搏动频率在前5 h逐渐增加,6 h后随着药物暴露时间的延长而降低,但仍然显著高于2D对照组,这可能是因为3D微环境中心肌细胞更为成熟;而加入DEX 5 h后,芯片组和2D对照组的心肌细胞搏动频率略有增加;定量分析结果显示,在添加DEX的实验组中,无论是否联合使用DOX,肌动蛋白的覆盖面积均显著高于DEX未添加组。这些结果提示,DEX和DOX具有临床相关性,该心脏芯片为药物开发过程中的心脏毒性评估提供了潜在平台。
3 生物3D打印模型的组织工程应用
在组织工程研究中,生物3D打印技术以构建具有生物学功能的3D组织结构为目标,致力于实现对受损人体组织的有效模拟、功能性修复或替代性重构,其应用范围涉及骨骼、皮肤、血管等组织。尽管3D生物打印在组织工程领域中已经取得一定进展,但该技术的打印分辨率不足、细胞长期存活率受限,以及在组织功能维持、血管化以及神经整合等方面的挑战仍然是限制其进一步发展的关键因素。
3.1 生物3D打印骨/软骨
在骨治疗领域,生物3D打印技术主要采用两种策略实现骨修复与重建。一是采用高性能材料制造生物3D打印植入物,这些植入物作为骨缺损部位的替代品,提供长期结构支持,以促进机体正常生理功能恢复[33]。二是借助可降解材料,通过生物3D打印构建骨支架,这些支架能促进自然骨再生,并随着骨再生过程逐步降解,最终完全被健康骨组织替代[34]。Yan等[35]使用聚己内酯制造了一种可降解支架,能够控制释放去铁胺,促进血管生成和骨再生,适用于节段性骨缺损的治疗。尽管生物3D打印骨支架在临床上已取得一定成果,但如何进一步提高支架的力学机械性能、模拟天然骨骼的多层次结构特征,以及增强自我修复能力,仍然是当前骨组织工程领域的研究重点。
生物3D打印技术同样适用于替换受伤或退行性变化的软骨组织。材料的合理选择是决定打印软骨组织功能与修复效果的关键。其中,水凝胶是软骨打印中极具前景的材料之一,其有高度的溶胀性和多孔性,利于营养物质的传输和多类型细胞的包裹,因此得到了广泛应用。水凝胶还具有可调节性,能够优化组织修复效果。此外,负载细胞的水凝胶可提供发育信号或模拟天然软骨的微环境信号,从而维持软骨形成表型,并促进基质形成[36]。
3.2 生物3D打印皮肤
皮肤作为人体最大的器官,约占成年人总体重的16%,具备保护、感知等多种功能。生物墨水的选择是生物3D打印皮肤模型的关键一环。甲基丙烯酰化明胶(gelatin methacryloyl,GelMA)作为当前使用最为广泛的生物墨水[37],在经天然聚合物的添加混合后,力学性能进一步增强,可适应皮肤组织工程的应用需求。Shi等[38]报道了一种由GelMA、胶原蛋白和酪氨酸酶制成的新型生物墨水,使用其进行皮肤治疗时,伤口愈合速度加快。Jin等[39]开发了一种可模拟自然全层皮肤三层结构的生物3D打印模型,由GelMA和人类表皮角质构成的表皮层、成纤维细胞和人类脱细胞真皮基质构成的真皮层、由HUVECs和GelMA构成的血管网络和框架复合而成。该离体皮肤模型为细胞生长和仿生构建提供了最佳微环境。尽管生物3D打印在皮肤组织工程中展现出巨大潜力,能够克服传统治疗方法的不足,但仍面临着诸多挑战,例如需要提高打印分辨率和改善生物材料性能。
3.3 生物3D打印血管
目前,心血管疾病治疗主要依赖于支架介入和心脏搭桥手术。自体血管移植因供体有限且采集过程存在感染或二次伤害的风险,难以满足临床需求。同种异体血管和异种血管移植则面临免疫排斥反应的技术瓶颈。因此,开发人工血管模型至关重要,而组织工程的发展使得构建新型人工血管模型成为了研究热点。生物3D打印技术作为组织工程领域的新兴技术,在调控血管支架微观结构如孔径大小、几何形态及互连性等方面具有显著优势。
然而,由于准备时间长和细胞消耗量大,以细胞和单一成分的材料作为生物墨水的生物3D打印血管模型仍存在细胞存活率过低等问题。因此,复合型材料成为优化此类模型性能的重要选择。Gold等[40]构建了一种由GelMA、纳米硅酸盐和血管平滑肌细胞组成的人工血管模型,并在血管结构内层接种了内皮细胞;实验结果显示,这两种细胞均在人工血管模型中表现出较高的存活率。Wu等[41]将纳米蒙脱石粉末混合明胶和海藻酸钠制成了一种新的生物墨水,该生物墨水打印的支架具有较大的断裂伸长率,接近天然乳腺组织中的动脉,还具备良好的抗蠕变性能和热稳定性;溶血试验和体外细胞培养结果表明,此血管支架的溶血率仅为3.75%,符合医学标准,且细胞毒性弱,生物相容性好。以上研究结果可为人工血管的临床转化提供有益参考。
4 生物3D打印模型与动物模型的交叉应用
将生物3D打印模型与传统非临床模型如动物模型交叉应用,能够更有效地模拟人体内的复杂生物学过程,可望在疾病机制、精准医疗、药物研发和组织再生等方面取得研究突破。
4.1 机制研究
生物3D打印模型与动物模型在机制研究中的互补性主要体现在两个方面。一方面,3D打印模型在模拟疾病微环境方面的精细度,与动物模型具有的整体化和复杂性特征相结合,可为研究者提供一个更为全面的疾病进展研究平台。另一方面,3D打印模型提供的细胞水平和微环境相关数据,与动物模型提供的生理和免疫数据相互补充,有助于揭示疾病发生发展的深层次机制。例如López-Carrasco等[42]通过比较不同力学刚度的神经母细胞瘤体外3D打印模型,证实在高刚度和长培养时间的3D打印模型中,肿瘤细胞表现出显著的部分染色体畸变负选择,揭示了适应性压力下染色体异常和克隆选择的机制;而且动物实验发现肿瘤连续传递中基因组变化的结果,在高刚度水凝胶培养的细胞模型中得到了验证,显示出与玻连蛋白基因敲除小鼠模型中相似的9号染色体异常,二者结合可共同证实与刚度相关的基因型变化。
近年来,药物研发人员也正在尝试整合两种模型的优势,如利用3D打印技术构建肿瘤类器官模型开展动物药效学实验。Ren等[43]在NSG小鼠(一种免疫缺陷程度最高的工具小鼠)的肝脏中植入表达荧光素酶的胆道癌类器官,建立原位人肿瘤异种移植模型,并验证类器官筛选出的药物效果。结果表明,胆道癌类器官模型对药物的反应及基于类器官的异种移植小鼠的治疗效果,与患者临床治疗反应具有高度一致性,如患者ICC65T的类器官对5-氟尿嘧啶敏感性较高,因此在后续的治疗中选用5-氟尿嘧啶的前体物卡培他滨作为治疗药物,而为期4至26个月的随访结果显示该患者无复发现象。该策略有效优化了药物在模拟生理环境中的评估体系,显著降低了药物研发失败率,为揭示肿瘤复杂病理过程和开发新型治疗方法提供了重要技术支撑。未来,非临床模型的协同优化将成为疾病机制研究和药物研发的重要方向,推动个性化医学的持续发展。
4.2 精准医疗
精准医疗是肿瘤治疗中的关键策略,可依据患者的个体特性、遗传信息、临床表型等构建个性化的最佳医疗方案,是未来医学发展的重要方向之一。生物3D打印模型和患者来源的肿瘤异种移植(patient-derived tumor xenograft,PDX)模型(一种通过将患者肿瘤组织移植到免疫缺陷动物体内构建的临床前研究模型)均是精准医疗的重要组成部分,但适用范围有所不同。生物3D打印模型能对直接靶向肿瘤及其微环境的药物进行快速评估,而PDX动物模型则更适用于需要经过体内代谢和涉及多器官相互作用的药物类型。
利用生物3D打印技术可对化疗、靶向治疗、免疫疗法等多种药物类型以及其组合进行评估,通过精准控制药物的释放,为每位患者提供定制化的药物筛选平台,从而有效降低药物不良反应发生率,以及规避无效治疗。而在此基础上进行的细胞迁移、侵袭特性和分子机制特征的研究,则为深入理解肿瘤的发生、发展和转移提供了支持[44]。Zhao等[45]使用患者来源的细胞构建肺癌3D打印模型,并与2D单层细胞模型对比,发现3D打印模型对靶向药物表现出更高的敏感性,且药效反应结果具有更高的动物实验一致性。Al Shihabi等[46]收集了126例肉瘤患者的194个样本(涵盖了24种不同的肉瘤亚型),使用患者衍生的生物3D打印肿瘤类器官建立了一个高通量类器官筛选流程,通过该流程测试单一药物和组合治疗个体患者的药物敏感性和耐药性,为患者定制治疗方案;实验结果显示,59%的样本至少识别出一种FDA批准或美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐的有效治疗方案,80.4%的样本至少对一种测试药物表现出显著反应。此外,Sun等[47]利用生物3D打印技术构建的结直肠癌及其肝转移的患者衍生肿瘤模型,可以预测个体化疗反应;该模型能够维持原始肿瘤的生物标志物和突变谱,并保持了肿瘤异质性,从而与化疗的临床结果表现出强相关性。上述结果表明,生物3D打印模型在辅助临床个性化抗癌药物筛选方面极有应用潜力。
PDX动物模型在组织病理学、分子生物学、分子遗传学、结构复杂性、肿瘤异质性和微环境特征上保留了大部分原代肿瘤的特点[48],因此具有较好的临床预测效果。Li等[49]使用4名患者的肿瘤样本构建PDX动物模型(前3例患者的长链非编码RNA LYPLAL1-DT的表达水平显著高于第4例患者);研究结果显示,LYPLAL1-DT高表达的PDX模型中,维奈托克(Venetoclax)和羟氯喹(hydroxychloroquine)显著增强了顺铂、依托泊苷或紫杉醇诱导的肿瘤细胞死亡,部分模型甚至出现肿瘤细胞消失现象。该研究结果不仅表明PDX模型在指导患者个性化用药方面具有重要价值,同时也验证了药物联合疗法的显著治疗效果,并确定了该疗法的临床适用范围。PDX模型的药物适用范围更全面,其完整的消化吸收系统使其对评估多肽类药物、口服药物和部分中药等需要代谢的药物更为适宜。用于精准医疗的常见模型对比详见表1。
表1 精准医疗常见模型对比
Table 1
模型类型 Model types | 2D细胞模型 2D cell model | 生物3D打印模型 3D bioprinting model | PDX动物模型 Patient-derived xenograft animal model |
|---|---|---|---|
| 实验周期 Experimental cycle | 1周内 | 7 d | 3~6个月 |
| 成本 Cost | 1 000~2 000元/例 | 数万元/批 | 数十万元/批 |
| 建模成功率 Modeling success rate | 高 (>90%) [51] | 高 (>80%) [52] | 低 (>60%) [53] |
| 临床相关性 Clinical relevance | 有限 | 高 | 高 |
| 遗传信息保真度Genetic information fidelity | 有限 | 高 | 高 |
| 可重复性 Reproducibility | 高 | 高 | 低 |
| 细胞种类 Cell types | 有限 | 多样化,含有多种细胞 | 多样化,但受鼠源细胞影响 |
| 系统完整性 System integrity | 低,仅细胞层面 | 中等,组织/器官层面,尚缺乏动态 循环和整体性调控 | 高,具有完整生理环境 |
| 材料可控性 Material controllability | 无 | 高 | 低 |
| 通量 Throughput | 高 | 高 | 低 |
近年来,AI模型也逐渐成为精准医疗的关键工具。如采用AI驱动的多组学分析技术构建的非临床模型可为晚期恶性肿瘤患者匹配临床试验[50],接受治疗后患者的客观缓解率为29.2%,比未接受AI匹配治疗的患者总生存期延长。AI算法还能够分析患者个体的基因组数据,预测特定药物的反应,从而指导临床用药方案。
4.3 药物研发
在药物发现与开发流程中,体外高通量筛选至关重要。当前的高通量筛选主要是基于2D细胞培养模型,生物3D打印模型在此基础上提升了筛选的临床相关性,同时满足了筛选阶段对速度和可重复性的要求,进一步提高了药物筛选结果的验证准确性并节约了研发资源。
生物3D打印技术已经成功应用于高通量筛选,特别是在单器官的构建和筛选以及和其他技术联用方面表现突出。Herpers等[54]建立的结直肠癌类器官样本库,可对超过500种靶向Wnt和受体酪氨酸激酶(receptor tyrosine kinase,RTK)信号转导通路的双特异性抗体进行高通量成像筛选,发现MCLA-158(一种LGR5×EGFR双特异性抗体)可以特异性降解LGR5+肿瘤干细胞表面的表皮生长因子受体(epidermal growth factor receptor,EGFR),从而杀伤肿瘤,而对正常的结肠类器官毒性很小,并在几种上皮癌类型的非临床模型中表现出治疗效果。次年,MCLA-158就获得了美国FDA的新药临床试验批准。Tebon等[3]通过生物3D打印技术进行自动化细胞接种,并结合高速活细胞干涉测量法(high-speed living cell interferometry,HSLCI),实现无创、无标记、时间分辨成像,从而达到对多个类器官实施连续动态质量监控的目的,最终实现对单个类器官中的药物反应量化。HSLCI与AI结合后,可进一步将类器官检测量提升至数千量级,且患者衍生类器官可在手术1周内给出筛选结果,从而指导临床用药。另外,生物3D打印技术和微流体系统结合后,能同时对4个芯片展开研究[55];相较于传统的单次仅能研究一种药物的芯片,增加了高通量的特性。
4.4 组织再生研究
在组织再生领域,器官移植供体不足、免疫排斥反应难以规避以及医学伦理争议等问题长期制约着临床实践与学科发展。生物3D打印技术的发展为这些问题提供了新的解决策略。该技术通过模拟机体的创伤愈合和发育过程,植入高活性生物材料负载的类器官,调控损伤局部的微环境,诱导内源性干细胞向缺损部位快速募集并激活其定向分化,从而实现组织的再生与修复。
具体而言,生物3D打印技术在组织再生中的应用,主要是定向诱导干细胞分化,并在3D微环境中培养类器官。这些类器官能够在体内部分行使衰竭器官的功能,为器官移植提供了创新性替代治疗方案,有效缓解了器官供体不足的问题。同时,在材料学领域,有关重组ECM的研究可能有助于逐步解决免疫排斥问题。利用患者来源的干细胞进行生物3D打印培养类器官用于自体移植,可在提供健康的个体类器官的基础上,保持遗传信息的稳定性,而且避免了传统器官移植中的伦理争议。例如,Hong等[56]利用3D打印技术制备了具有肝小叶样结构的微组织球体模型,不仅可维持结构完整,其中肝功能关键酶的表达水平高,在移植后显示出良好的细胞存活率,而且在Matrigel植入实验中产生了功能性血管,免疫组化染色样本中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和CD31染色显示结构化微组织球体内部的细胞密度更高,有血管生长的迹象,提示该模型对于肝器官修复或代替表现出巨大潜力。
生物3D打印作为一种非动物性替代实验方法与动物模型的联合应用,是组织再生治疗领域研究中不可或缺的一环。例如,Lopez等[57]通过动物实验评估了一种3D打印的真皮代替物,结果显示该代替物的植入率为91.8%,组织学评分为75%±8%,结构均匀,可以作为自体分割厚度皮肤移植的代替物,且能够避免自体移植全身麻醉和供体部位疤痕等缺点。目前,3D打印模型和动物实验在心脏血管[58]、肝脏[59]、气管[60]、肌肉[61]、椎间盘[62]、肠道[63]、毛囊[64]等多种器官组织的再生和修复上均有联合应用,特别是当行为学作为重要观察指标时,动物模型能够模拟体内复杂生理环境与生物力学条件,其提供的临床前数据是其他体外模型无法替代的。
综上所述,生物3D打印技术不仅在药物研发领域得到广泛认可,而且在再生医学领域其应用将成为未来研究的重点;而动物实验将在生物3D打印技术向临床转化的过程中持续发挥重要作用。技术的交叉融合不仅为重大损伤和疾病的治疗提供了新方案,同时为医学伦理和可持续发展提供了新视角。
5 总结与展望
生物3D打印技术为医药研究领域带来了巨大变革,该技术在药物研发、组织工程等领域已取得一定进展,体现了其模拟复杂生物系统的潜力。然而,科研人员不能止步于此,还需要积极探索跨学科合作的新领域。其中,生物3D打印技术与AI的融合,以及它与其他非临床模型尤其是动物模型之间的结合,将成为当下研究的热点方向。
当前,AI技术已经被证实在动物模型的创建和分析中具有关键作用。该技术可通过预测药物反应和疾病进程来减少临床前试验研究对实验动物的依赖,并且提高研究的准确性和效率。生物3D打印技术作为新型非动物实验方法已获认可,其与AI技术的结合应用已成为必然趋势。Ng等[65]全面阐述了AI技术在生物3D打印中的多种作用,包括微调打印参数以提高打印质量,运用神经网络算法优化打印参数,以及开发实时监测和纠错机制,从而减少材料试错成本和时间成本。AI技术的应用还能加速新型生物墨水的研发,并借助高通量药物筛选提高预测能力,从而在动物实验前剔除无效药物。同时,结合患者特异性数据的AI技术,能够优化生物打印组织的构建,实现个性化和精准治疗。当然,生物3D打印模型与AI技术的结合在目前仍面临诸多挑战。例如,需要大量高质量的数据来提供可靠依据,因此数据的来源和系统收集成为二者交叉应用研究面临的瓶颈之一。究其原因,数据集质量与AI模型的泛化能力和准确性密切相关,这使得高质量的训练数据集成为AI发挥预测能力的基石。因此,如何进行有效数据筛选和标准化是生物3D打印与AI技术的交叉应用需要攻克的关键难题。
与此同时,生物3D打印模型与其他非临床模型的应用形成了互补的紧密网络。例如,生物3D打印模型具有高度仿生、可精确模拟、便于研究细胞及分子水平的优势,但缺乏整体化和疾病动态发展的环境;而动物模型因具有完整的生物系统,在模拟疾病整体性和复杂性方面具有独特优势,但存在精细控制难度较大和伦理争议等问题。因此,二者的交叉应用即可拓宽研究维度,有助于揭示疾病机制和个体差异性。目前,这一交叉应用模式已在多种疾病机制、毒理研究、组织工程、药物研发、精准医疗等领域得到拓展。生物3D打印技术与动物模型的结合同样适用于药效测试,如在开展动物实验前可先使用生物3D打印模型排除无效药物,从而优化动物实验的前期流程。
此外,生物3D打印还可与其他非临床模型结合,例如在生物3D打印模型中引入微流控系统以实现长期培养,这是研究人员应对生物3D打印模型在模拟动态、复杂生物系统挑战方面的尝试。尽管这些技术的结合目前仍处于起步阶段,但已为生物医学研究提供了新的视角和方法。因此,从长远发展趋势来看,生物3D打印模型与其他非临床模型的交叉应用将持续推动医药事业的发展,有望在疾病机制解析、创新药物开发及个性化医疗实践等领域成为推动医药事业创新发展的核心驱动力。
[引用本文]
胡敏, 董乐轩, 高怡, 等. 生物3D打印研究及与临床前动物模型的交叉应 用 展 望 [J]. 实 验 动 物 与 比 较 医 学 , 2025, 45(3): 318-330. DOI:10.12300/j.issn.1674-5817.2024.193.
HU M, DONG L X, GAO Y, et al. Prospects for 3D bioprintingresearch and transdisciplinary application to preclinical animalmodels[J]. Lab Anim Comp Med, 2025, 45(3): 318-330. DOI:10.12300/j.issn.1674-5817.2024.193.
作者贡献声明
胡敏负责“生物3D打印技术介绍”“医药研发应用”“总结与展望”部分的写作,参与全文修改;
董乐轩负责“生物3D打印模型与动物模型的交叉应用”部分的写作,参与全文修改;
高怡负责文献搜集,参与“总结与展望”部分的写作以及全文修改;
奚子芪负责“生物3D打印模型的组织工程应用”部分的写作及修改;
沈子皓和唐瑞阳参与“引言”和“总结与展望”部分的写作;
栾鑫参与文章审阅和修改审校;
汤忞负责写作方案策划,以及全文修改和定稿;
张卫东参与文章选题构思和修改审校。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
The flaws and human harms of animal experimentation
[J].
Laboratory environments and rodents' behavioural needs: a review
[J].
Drug screening at single-organoid resolution via bioprinting and interferometry
[J].
Light-based vat-polymerization bioprinting
[J].
A 3D bioprinting system to produce human-scale tissue constructs with structural integrity
[J].
Recent advances in bioink design for 3D bioprinting of tissues and organs
[J].
Tissue-specific hydrogels for three-dimensional printing and potential application in peripheral nerve regeneration
[J].
3D bioprinting of complex tissues in vitro: state-of-the-art and future perspectives
[J].
Biomaterials and 3D bioprinting strategies to model glioblastoma and the blood-brain barrier
[J].
A review of 3D printing technologies for soft polymer materials
[J].
Limitations of animal studies for predicting toxicity in clinical trials: is it time to rethink our current approach?
[J].
Automated microfluidic platform for dynamic and combinatorial drug screening of tumor organoids
[J].
A 3D bioprinted human neurovascular unit model of glioblastoma tumor growth
[J].
3D bioprinted breast cancer model reveals stroma-mediated modulation of extracellular matrix and radiosensitivity
[J].
Three-dimensional bioprinted glioblastoma microenvironments model cellular dependencies and immune interactions
[J].
Rapid 3D bioprinting of glioblastoma model mimicking native biophysical heterogeneity
[J].
Heat-inducible CAR-T overcomes adverse mechanical tumor microenvironment in a 3D bioprinted glioblastoma model
[J].
3D printed nervous system on a chip
[J].
Biofabrication of an in-vitro bone model for Gaucher disease
[J].
Patients' stem cells differentiation in a 3D environment as a promising experimental tool for the study of amyotrophic lateral sclerosis
[J].
Prevention of cardiovascular disease through reduction of glycaemic exposure in type 2 diabetes: a perspective on glucose-lowering interventions
[J].
3D bioprinting of liver models: a systematic scoping review of methods, bioinks, and reporting quality
[J].
Bioprinted 3D primary liver tissues allow assessment of organ-level response to clinical drug induced toxicity in vitro
[J].
Mimicking native liver lobule microarchitecture in vitro with parenchymal and non-parenchymal cells using 3D bioprinting for drug toxicity and drug screening applications
[J].
Bioprinting of a hepatic tissue model using human-induced pluripotent stem cell-derived hepatocytes for drug-induced hepatotoxicity evaluation
[J].
Microfluidic human physiomimetic liver model as a screening platform for drug induced liver injury
[J].
Drug attrition during pre-clinical and clinical development: understanding and managing drug-induced cardiotoxicity
[J].
Recent applications of three-dimensional bioprinting in drug discovery and development
[J].
Drug response analysis for scaffold-free cardiac constructs fabricated using bio-3D printer
[J].
Design and fabrication of mature engineered pre-cardiac tissue utilizing 3D bioprinting technology and enzymatically crosslinking hydrogel
[J].
Multiscale anisotropic scaffold integrating 3D printing and electrospinning techniques as a heart-on-a-chip platform for evaluating drug-induced cardiotoxicity
[J].
生物3D打印在肿瘤研究及组织工程中的应用
[J].
Application of 3D bioprinting in cancer research and tissue engineering
[J].
Application of bioactive materials for osteogenic function in bone tissue engineering
[J].
Vascularized 3D printed scaffolds for promoting bone regeneration
[J].
Recent advances in hydrogels for cartilage tissue engineering
[J].
3D bioprinting for skin tissue engineering: Current status and perspectives
[J].
Tyrosinase-doped bioink for 3D bioprinting of living skin constructs
[J].
Three-dimensional bioprinting of a full-thickness functional skin model using acellular dermal matrix and gelatin methacrylamide bioink
[J].
3D bioprinted multicellular vascular models
[J].
Freestanding vascular scaffolds engineered by direct 3D printing with Gt-Alg-MMT bioinks
[J].
Impact of extracellular matrix stiffness on genomic heterogeneity in MYCN-amplified neuro-blastoma cell line
[J].
Personalized drug screening in patient-derived organoids of biliary tract cancer and its clinical application
[J].
Inhibition of the mTOR pathway and reprogramming of protein synthesis by MDM4 reduce ovarian cancer metastatic properties
[J].
Construction of a lung cancer 3D culture model based on alginate/gelatin micro-beads for drug evaluation
[J].
The landscape of drug sensitivity and resistance in sarcoma
[J].
Prediction of clinical precision chemotherapy by patient-derived 3D bioprinting models of colorectal cancer and its liver metastases
[J].
Integrative ensemble modelling of cetuximab sensitivity in colorectal cancer patient-derived xenografts
[J].
Overcoming multi-drug resistance in SCLC: A synergistic approach with venetoclax and hydroxychloroquine targeting the lncRNA LYPLAL1-DT/BCL2/BECN1 pathway
[J].
The SCRUM-MONSTAR cancer-omics ecosystem: striving for a quantum leap in precision medicine
[J].
基于3D生物打印技术构建肺癌体外模型
[D].
A lung cancer model in vitro was constructed based on 3D bioprinting
[D].
基于3D生物打印技术构建人源消化系恶性肿瘤临床前模型及其临床应用研究
[D].
Construction and clinical application research on human-derived preclinical models of gastrointestinal cancer based on 3D bioprinting technology
[D].
PDX模型在妇科肿瘤中的研究进展
[J].
Research progress of PDX model in gynecological tumors
[J].
Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors
[J].
Efficacy of recombinant Bacillus Calmette-Guérin containing dltA in in vivo three-dimensional bio-printed bladder cancer-on-a-chip and ex vivo orthotopic mouse model
[J].
Production of multiple cell-laden microtissue spheroids with a biomimetic hepatic-lobule-like structure
[J].
In vivo efficacy proof of concept of a large-size bioprinted dermo-epidermal substitute for permanent wound coverage
[J].
hESCs-derived early vascular cell spheroids for cardiac tissue vascular engineering and myocardial infarction treatment
[J].
Liver bioprinting within a novel support medium with functionalized spheroids, hepatic vein structures, and enhanced post-transplantation vascularization
[J].
Instant Trachea reconstruction using 3D-bioprinted C-shape biomimetic Trachea based on tissue-specific matrix hydrogels
[J].
Bioprinted Notch ligand to function as stem cell niche improves muscle regeneration in dystrophic muscle
[J].
A 3D-Bioprinted dual growth factor-releasing intervertebral disc scaffold induces nucleus pulposus and annulus fibrosus reconstruction
[J].
Extracellular matrix bioink boosts stemness and facilitates transplantation of intestinal organoids as a biosafe Matrigel alternative
[J].
Bioprinting of hair follicle germs for hair regenerative medicine
[J].
Progress and opportunities for machine learning in materials and processes of additive manufacturing
[J].