1 材料与方法
1.1 实验动物及饲养环境
SPF级雄性SD大鼠28只,11周龄,体重为(330±10)g,购自北京华阜康生物科技股份有限公司[SCXK(京)2019-0008],饲养在山西中医药大学屏障环境实验室[SYXK(晋)2020-0006]。本研究方案通过山西中医药大学医学伦理委员会和山西省中医药研究院医学伦理委员会批准(AWE202312409、SZYLY2024KY-0302),所有实验操作均符合实验动物伦理要求。
1.2 主要试剂与仪器
酒石酸长春瑞滨注射液(江苏豪森药业集团有限公司,批号600210701);异氟烷(山东安特牧业科技有限公司,批号151987015);脱毛膏[利洁时(苏州)有限公司,批号11734];R540IE型小动物麻醉机(深圳瑞沃德生命科技股份有限公司);PV-200型足趾容积测量仪和PH-200型双足平衡测痛仪(成都泰盟科技有限公司);628C型红外热像仪[含AnalyzIR分析系统,飞础科智慧科技(上海)有限公司];SU8100型扫描电子显微镜(日本Hitachi公司);BX61正置显微镜(日本Olympus公司);HM325型石蜡切片机(美国Thermo Fisher Scientific公司)。
1.3 大鼠足背静脉炎模型制作及评价流程
28只大鼠用脱毛膏脱去右后肢背侧毛发备皮,次日经2%异氟烷麻醉,橡皮筋结扎后肢踝关节上2 cm处以充分显露静脉,医用酒精(即75%乙醇溶液)棉球擦拭足背,0.45 mm×1.5 mm输液针穿刺足背静脉。其中20只大鼠一次性注射0.1 mL质量浓度为4 mg/mL的长春瑞滨溶液,作为模型组;8只大鼠注射等体积生理盐水(即0.9% NaCl溶液),作为对照组。注射完成后,按压针口至无血液外漏。每日观察对照组和模型组(随机抽取8只)大鼠的活动、进食及被毛等情况,记录静脉炎分级,测量患肢体积,计算肿胀率,拍摄热像图,记录患肢局部皮肤温度,测量患肢承重占比,持续9 d。同时,分别在第1天、第3天、第5天和第7天,从其余12只模型组大鼠中随机选取3只处死,取从注射点至近心端1 cm处的静脉组织进行病理学观察。第9天观察结束后,对照组和模型组8只大鼠均处死,同法取材。
1.4 模型评价相关指标
肿胀率:采用排水法测量患肢体积。将实验大鼠后肢放入容积测量仪装有水的烧杯中,浸入至踝关节上2 cm处,待示数稳定后记录水体积。计算公式:肿胀率(%)=(造模后容积-造模前初始容积)/造模前初始容积×100%。
患肢承重占比:将大鼠放入双足平衡测痛仪,倾斜测试盒使其左、右后足分别置于左、右压力传感器中央,待动物安静后记录双足压力。计算公式:承重占比(%)=右后足压力/双足压力总和×100%。
皮肤温度:将大鼠右后肢向外平展于水平桌面,用红外热像仪于距离45 cm高度处垂直拍摄患肢从注射点至向心端5 cm的部位,用AnalyzlR系统自动分析病灶部位平均温度。
静脉炎分级:每日肉眼观察大鼠患肢颜色、肿胀及皮损程度等,参考美国护理学会2021年版《输液治疗护理实践标准静脉炎分级标准》[11]进行评级:无症状为0级;穿刺点局部发红为Ⅰ级;局部红斑或水肿为Ⅱ级;红斑、水肿、条索状静脉为Ⅲ级;红斑和水肿显著,条索状静脉形成,伴局部溃烂或脓液流出,记为Ⅳ级。
1.5 大鼠静脉组织病理学观察
采用CO2安乐死法处死大鼠,取右后肢足背(从注射点至向心端1 cm范围)静脉组织置于3%戊二醛溶液中固定4 h,用0.1 mol/L磷酸缓冲液漂洗3次,每次10 min;然后放入1%锇酸溶液中固定2 h,用0.1 mol/L磷酸缓冲液漂洗3次,每次10 min;经乙醇溶液梯度脱水后冷冻干燥,经离子溅射仪镀膜制作电镜标本,用扫描电子显微镜观察静脉血管内膜超微结构。同时留取一部分后肢静脉组织置于4%多聚甲醛溶液中固定过夜,常规脱水,石蜡包埋,切片,苏木精-伊红染色后,光学显微镜下观察病理学变化。
1.6 统计学分析
采用SPSS 27.0软件分析实验数据。肿胀率、患肢承重占比和皮肤温度用平均数±标准差表示,采用独立样本t检验进行组间比较;2组间的静脉炎分级比较则采用Kruskal-Wallis H非参数检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 足背静脉炎模型大鼠的患肢外观变化
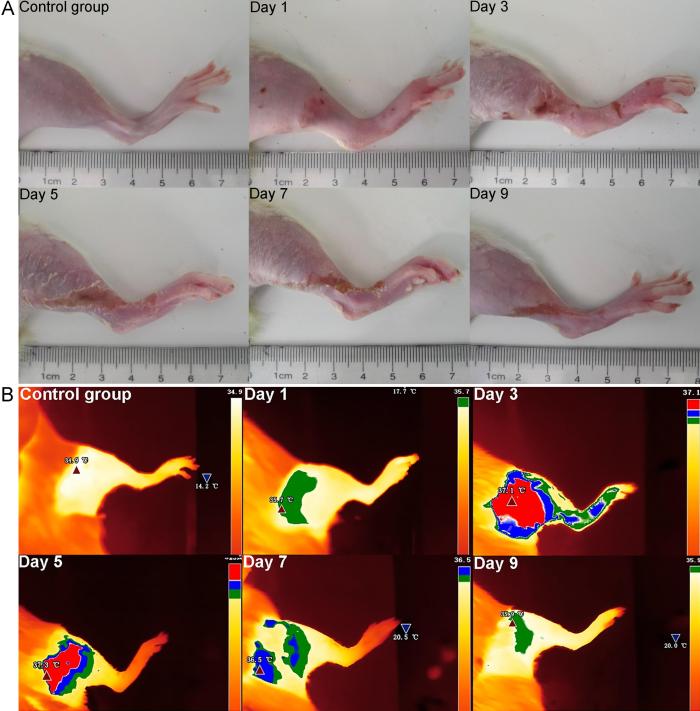
实验期间两组大鼠状态良好,被毛平顺有光泽,饮水及进食正常。如图1A所示,对照组大鼠右后肢皮肤光滑润泽且无红肿;模型组大鼠在注射后第1天可见右后肢红肿及充血性红斑;第3天患肢肿胀进一步加剧,局部皮肤破溃及脱屑;第5天红肿减轻,脱屑减少,溃烂面积开始缩小;第7天红肿明显消退,脱屑进一步减少,溃烂处干燥结痂;第9天结痂颜色变浅,可观察到条索状静脉或串珠样静脉堵塞。
图1
图1
足背静脉炎模型大鼠不同时间点的患肢外观(A)和红外热成像(B)图
Figure 1
Appearances (A) and infrared thermal images (B) of the injured limbs of phlebitis model rats at different time points
2.2 足背静脉炎模型大鼠的患肢肿胀率变化
对照组大鼠在实验期间右后肢无肿胀,而注射长春瑞滨溶液的模型组大鼠右后肢第1天即出现明显肿胀,第3天肿胀程度最严重,之后至第9天逐渐减轻。不同时间点的两组大鼠注射侧后肢肿胀率数据见表1;在同一时间点比较,模型组大鼠的患肢肿胀率均大于对照组,差异有统计学意义(P<0.01)。
表1
足背静脉炎模型大鼠不同时间点的患肢肿胀率、承重占比和平均温度 (
Table 1
时间点 Time points | 肿胀率/% Swelling rate/% | 承重占比/% Proportion of weight-bearing capacity/% | 平均温度/℃ Average temperature/℃ | |||||
|---|---|---|---|---|---|---|---|---|
对照组 Control group | 模型组 Model group | 对照组 Control group | 模型组 Model group | 对照组 Control group | 模型组 Model group | |||
| Day 1 | 0.91±0.89 | 25.49±7.93** | 51.44±0.04 | 44.58±0.86** | 34.35±0.58 | 34.75±0.68 | ||
| Day 3 | 0.99±0.53 | 81.89±15.75*** | 49.92±1.75 | 36.35±4.91*** | 33.85±0.42 | 35.17±0.81** | ||
| Day 5 | 1.51±0.30 | 63.03±1.41*** | 49.49±0.09 | 44.29±0.08** | 34.03±0.77 | 36.36±0.40*** | ||
| Day 7 | 1.58±0.44 | 29.75±5.91** | 49.90±1.85 | 47.71±0.25 | 35.10±0.43 | 35.28±0.80 | ||
| Day 9 | 0.30±0.17 | 15.41±0.33** | 50.86±1.49 | 49.67±1.19 | 34.40±0.44 | 34.88±0.63 | ||
2.3 足背静脉炎模型大鼠的患肢承重占比变化
如表1所示,对照组大鼠在实验期间右后肢承重占比均约为双足总压力的50%,且无明显变化;与对照组比较,模型组大鼠的右后肢承重占比在造模后第1天即出现明显降低(P<0.01),第3天降至最低(P<0.001),此后逐步上升,从第7天开始基本恢复至与对照组无显著差异(P>0.05)。
2.4 足背静脉炎模型大鼠的患肢皮肤温度变化
2.5 足背静脉炎模型大鼠的患肢静脉炎分级变化
实验期间每日记录两组大鼠患肢的静脉炎分级,如表2所示。对照组大鼠静脉炎分级均为0级。模型组大鼠第1天后肢红肿,Ⅱ级占比为75.0%;第3天肿胀加剧,多数大鼠出现条索状静脉,且局部有溃烂或有脓液流出,Ⅲ级、Ⅳ级各占37.5%;第5、7和9天则以Ⅲ级为主,局部溃烂逐渐恢复,仍可见条索状静脉,至第9天Ⅱ级和Ⅲ级分别占37.5%和62.5%。Kruskal-Wallis H非参数检验显示,模型组在不同时间点的患肢静脉炎分级与对照组比较均有统计学意义(H=34.11,P<0.05)。
表2 足背静脉炎模型大鼠在不同时间点的静脉炎分级 (n(%))
Table 2
组别 Groups | 0级 0 grade | Ⅰ级 Ⅰ grade | Ⅱ级 Ⅱ grade | Ⅲ级 Ⅲ grade | Ⅳ级 Ⅳ grade | P值 P value |
|---|---|---|---|---|---|---|
| Control group | 8 (100.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | - |
| Day 1 | 0 (0.0) | 2 (25.0) | 6 (75.0) | 0 (0.0) | 0 (0.0) | 1.000 |
| Day 3 | 0 (0.0) | 0 (0.0) | 2 (25.0) | 3 (37.5) | 3 (37.5) | 0.001*** |
| Day 5 | 0 (0.0) | 0 (0.0) | 2 (25.0) | 4 (50.0) | 2 (25.0) | 0.001*** |
| Day 7 | 0 (0.0) | 0 (0.0) | 3 (37.5) | 5 (62.5) | 0 (0.0) | 0.014* |
| Day 9 | 0 (0.0) | 0 (0.0) | 3 (37.5) | 5 (62.5) | 0 (0.0) | 0.014* |
2.6 足背静脉炎模型大鼠的患肢静脉组织病理学变化
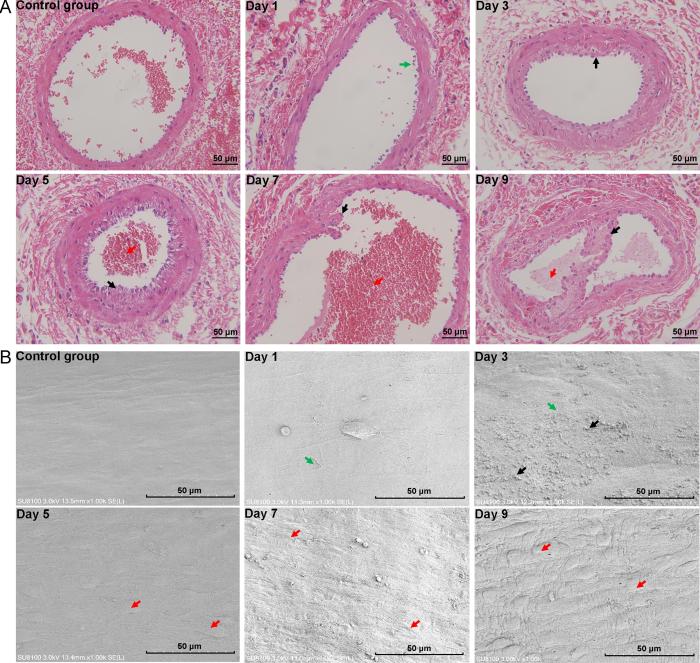
苏木精-伊红染色法观察大鼠右后肢足背静脉组织病理学改变,如图2A所示。对照组大鼠静脉管腔中空,内皮细胞排列整齐。模型组大鼠第1天静脉周围组织轻微水肿,有少量炎性细胞浸润;第3天静脉周围组织明显水肿,大量炎性细胞浸润,内膜不规则破溃,管壁纤维性增生变厚;第5天内膜纤维性增生导致管壁增厚并管腔狭窄,管腔聚集大量红细胞;第7天静脉壁增厚,内膜向管腔内凸起并有脱落,同时可见血栓;第9天静脉内膜纤维性增生严重,占据管腔并有血栓形成。
图2
图2
足背静脉炎模型大鼠在不同时间点的静脉组织病理学(×400)和血管内膜微观结构(×1 000)
Figure 2
Histopathology of vein tissues (×400) and microstructure of vascular intima (×1 000) in phlebitis model rats at different time points
2.7 足背静脉炎模型大鼠的患肢静脉内膜微观结构变化
扫描电子显微镜观察大鼠右后肢静脉血管内膜表面微观结构变化,如图2B所示。对照组大鼠静脉内膜可见纵行内皮细胞长轴,内膜完整光滑。模型组大鼠第1天静脉内皮细胞紧密连接轻微破坏,内膜表面破损以及剥脱;第3天内膜破溃且表面粗糙,粘附血细胞;第5天则基本缺失光滑表面,可见大量隆起内皮细胞;第7天静脉内膜缺失,至第9天可见不规则褶皱及隆起。
3 讨论
化疗性静脉炎是临床输液过程中常见的不良反应。本课题组根据多年临床经验,牵头制定了《化疗后静脉炎中医诊疗专家共识》并经中华中医药学会发布[12]。目前,常通过兔耳缘静脉或小鼠尾静脉注射刺激性药物构建化疗性静脉炎动物模型。兔耳缘静脉表浅清晰、覆毛少,但饲养条件高、成本昂贵,实际操作中兔耳缘静脉易扩张且耳温波动幅度大;小鼠易于饲养且成本低廉,但尾巴表面覆盖环状角质鳞片且尾静脉走行较深,不利于注射。兔耳和小鼠尾巴的肌肉软组织较少,所复制的静脉炎症状与临床实际存在一定差距,此外因解剖结构复杂,获取静脉组织困难,不利于血管微观结构观察。相比之下,大鼠足背静脉沿足背表面走行,其起始于跖骨静脉且向近心端上行至踝关节后汇合于外侧隐静脉[13]。因大鼠后肢接近人手背和前臂的解剖结构,故本课题组前期经大鼠后肢足背静脉注射长春瑞滨溶液成功构建了静脉炎模型[14],并初步用于课题组开发的复方藤芷凝胶贴膏剂药效学评价研究[15]。本研究在前期研究基础上重点观察该模型在不同时间点的患肢肿胀率、局部皮肤温度和承重占比,以及静脉炎分级、血管病理学和内膜表面结构等指标,进一步明确长春瑞滨溶液诱导大鼠后肢足背静脉炎模型的局部症状和静脉组织病理学变化特点。
本研究首先观察经后肢足背静脉注射长春瑞滨溶液诱导的静脉炎模型大鼠的红肿热痛和静脉炎分级随时间的变化情况。红外热成像测温技术是一种基于红外辐射原理的非接触式测温手段,能够迅速捕捉并显示物体表面的温度分布情况[16]。排水法则可以测量患肢肿胀率,双足平衡仪可测试患肢痛阈值。研究结果表明,长春瑞滨溶液注射造模的第1~3天为炎症急性期,局部炎症逐步加重,患肢局部皮肤温度逐渐升高,炎症病灶部位充血,出现患肢发红或红斑,炎性渗出物导致局部肿胀,并造成机械性阻塞等,进一步的缺血或缺氧等原因引起营养障碍性皮炎和组织坏死;至第3天,静脉炎分级以Ⅲ~Ⅳ级为主,肿胀率到达峰值,患肢承重占比到达最低,提示痛觉最为明显;第5天时,患肢局部皮肤温度达到最高,但红肿及痛觉逐渐消退,溃烂处结痂,皮肤出现干燥脱皮及萎缩,并可观察到静脉栓塞,至第7天红斑、发热和痛觉明显消退;第9天皮炎消失,但静脉炎分级仍以Ⅲ级为主,多数呈现条索状静脉,双足承重基本平衡且局部皮肤温度与正常大鼠相比已无明显差异,但仍有肿胀。
总体来看,经大鼠后肢足背静脉单次注射0.1 mL质量浓度为4 mg/mL的长春瑞滨溶液诱导的静脉炎模型在第3~5天以局部红、肿、热、痛为典型特征,至第9天基本消退,但局部静脉呈现瘀血条索状,静脉组织管壁增厚、管腔狭窄,同时静脉内膜破损、粗糙甚至缺失,可导致血流滞缓甚至血栓形成,从而影响血液循环。本研究构建的静脉炎大鼠模型具有操作简单和性价比高的优势,尤其是症状及病理变化接近临床病程,为相关治疗药物的开发和病理生理机制研究提供了一种潜在工具。
[引用本文]
姜萌, 郝淑兰, 仝立国, 等. 长春瑞滨诱导大鼠足背静脉炎模型动态评价研究[J]. 实验动物与比较医学, 2025, 45(3): 251-258. DOI: 10.12300/j.issn.1674-5817.2024.163.
JIANG M, HAO S L, TONG L G, et al. Dynamic evaluation ofvinorelbine-induced phlebitis of dorsalis pedis vein in a rat model[J]. Lab Anim Comp Med, 2025, 45(3): 251-258. DOI: 10.12300/j.issn.1674-5817.2024.163.
医学伦理声明
本研究涉及的所有动物实验方案均已通过山西中医药大学医学伦理委员会和山西省中医药研究院医学伦理委员会批准(审批号分别为AWE202312409和SZYLY2024KY-0302)。所有实验操作遵照中国实验动物相关法律法规条例要求进行。
Medical Ethics Statement
All animal experimental protocols involved in this study were approved by the Medical Ethics Committee of Shanxi University of Chinese Medicine and Medical Ethics Committee of Shanxi Province Academy of Traditional Chinese Medicine (Approval No. AWE202312409,SZYLY2024KY-0302). All experimental operations were carried out in accordance with the requirements of the relevant laws and regulations on experimental animals in China.
作者贡献声明
姜萌负责完成动物实验及论文初稿撰写;
郝淑兰负责实验监督与指导;
仝立国和仲启明负责数据整理、分析及论文修改;
高振飞负责实验指标测定;
王永辉负责提供实验动物、设施及场地;
王晞星和吉海杰负责实验方案设计及论文修订。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Effects of topical sesame (Sesamum indicum) oil on the pain severity of chemotherapy-induced phlebitis in patients with colorectal cancer: a randomized controlled trial
[J].
Vinorelbine: a clinical review
[J].
长春瑞滨药动学及毒副作用研究进展
[J].
Research progress on pharmacokinetics and toxicity of vinorelbine
[J].
Construction of a rabbit model with vinorelbine administration via peripherally inserted central catheter and dynamic monitoring of changes in phlebitis and thrombosis
[J].
Baicalein attenuates vinorelbine-induced vascular endothelial cell injury and chemotherapeutic phlebitis in rabbits
[J].
虎杖膏预防高渗药液致兔耳缘静脉炎的实验研究
[J].
Experimental study on giant knotweed cream for prevention of inflammation of rabbit ear vein induced by intravenously administered hypertonic solution
[J].
Chemotherapy-induced phlebitis via the GBP5/NLRP3 inflammasome axis and the therapeutic effect of aescin
[J].
Cimetidine attenuates vinorelbine-induced phlebitis in mice by militating E-selectin expression
[J].
N-acetylcysteine attenuates the incidence of phlebitis induced by carbomer / vinorelbine gel
[J].
长春瑞滨诱导化疗性静脉炎大鼠模型的构建和评价
[J].
Construction and evaluation of a chemotherapeutic phlebitis rat model induced by vinorelbine via the dorsalis pedis vein
[J].
Infusion therapy standards of practice, 8th edition
[J].
Unassisted blood collection from unanesthetized rats and gerbils
[J].
一种化疗性静脉炎大鼠模型的构建方法
Construction method of a rat model of chemotherapy-induced phlebitis
复方藤芷凝胶贴膏剂制备工艺及透皮主要成分研究
[J].
Research on the preparation process and transdermal main components of Fufang Tengzhi gel plaster
[J].
An experimental and clinical study of flap monitoring with an analysis of the clinical course of the flap using an infrared thermal camera
[J].
Role of venous endothelial cells in developmental and pathologic angiogenesis
[J].
Single cell sequencing reveals endothelial plasticity with transient mesenchymal activation after myocardial infarction
[J].
Piezo1 channel activation stimulates ATP production through enhancing mitochondrial respiration and glycolysis in vascular endothelial cells
[J].