犬瘟热(canine distemper,CD)是一种危害幼犬,具有高度传染性的病毒性疾病;其发病率高且致死速度快,可通过直接接触或飞沫传播,是一种在世界范围内分布广泛的疾病。该病是由犬瘟热病毒(canine distemper virus,CDV)感染导致。CDV属于副黏病毒科(paramyxoviridae)麻疹病毒属(morbillivirus),为RNA病毒。副黏病毒科还包含一系列高致病性的病毒,如麻疹病毒(measles virus,MeV)和牛瘟病毒(rinderpest virus,RPV)。与具有宿主特异性的MeV和RPV相比,CDV具有更显著的遗传多样性,其宿主范围很广,近些年更是突破了物种屏障[1-3]。有研究显示,CDV可以感染至少6个目、20多个科的哺乳动物,包括家畜种群,以及自由或圈养的野生动物界的多个物种[4-9]。CDV的主要宿主是犬和水貂,患病及带病毒的动物为主要传染源,主要通过动物的体液(鼻涕、唾液、尿液等)和粪便向外排毒。该病毒的组织侵蚀性非常广泛,有报道在患病动物的肝、肺、肾、淋巴结、脾、脑等器官组织中均可检测到病毒[10-11]。
除犬科、浣熊科、熊科、鼬科、猫科外,非人灵长类动物对CDV也敏感[12-15]。最早感染非人灵长类动物的病例是1989年由Yoshikawa等[13]在自然感染犬瘟热病毒的日本猕猴中发现。近年来,CDV在非人灵长类动物中的感染时有报道,且非人灵长类动物感染后有2%~60%的致死率[10]。2006年,在我国广西发生过恒河猴的感染[11]。笔者所在单位苏州西山生物技术有限公司(下文简称本单位)在2019年底接收了一批来自华南一猴场疑似CDV感染的食蟹猴样本。本研究通过对患病动物临床表现症状追溯、分子生物学检测及所分离病毒的亲缘关系分析,确诊该猴场的食蟹猴感染了CDV;同时结合本单位多年来针对非人灵长类动物CDV的检测数据以及该猴场的隔离检测数据,探讨了CDV的诊断及控制措施,以期为开展CDV研究工作的同行提供技术参考。
1 材料与方法
1.1 临床送检样本
来自华南地区某实验猴养殖场的21只患病食蟹猴的血清、皮肤红疹拭子样本,以及1只病死食蟹猴的EDTA抗凝全血、破溃皮肤、肺和肝脏组织,共46份样本,通过冷链运输,于2019年底送至本单位。随后本单位在2019年底及次年1月对送检样本进行鉴定诊断。
1.2 主要试剂及仪器
DNA/RNA共提取试剂盒(DP422)购自天根生化科技(北京)有限公司;随机引物由苏州金唯智生物科技有限公司合成;逆转录酶(2641A)购自日本TaKaRa公司;小鼠抗CDV单抗(MA1-82327)购自美国Thermo Fisher公司;免疫显色试剂(IHC-BD03-1)和DAB染色液(1904001)均购自广州安必平医药科技股份有限公司;病毒研究用MDCK细胞系购自北京北纳创联生物技术研究院;DMEM维持培养基(SH30243.01)购自美国HyClone公司。PCR仪(ABI 7500)购自美国Thermo Fisher公司;显微镜(BX43F)购自日本Olympus公司。
1.3 RNA提取及实时荧光定量PCR反应
取21只患病猴血清、红疹拭子及1只病死猴的全血、皮肤、肺和肝脏组织,用DNA/RNA共提取试剂盒提取RNA,严格按照试剂盒说明书进行操作。提取的RNA用60 μL无RNA酶水洗脱,并用随机引物和逆转录酶逆转录为cDNA。逆转录反应体系共20 μL,含RNA模板9 μL、100 μmol/L随机引物1 μL、5×M-MLV Buffer 4 μL、200 U/μL逆转录酶0.5 μL、40 U/μL逆转录酶抑制剂0.5 μL、2.5 mmol/L dNTP 4 μL和RNase-Free ddH2O 1 μL。逆转录反应程序:42 ℃ 10 min,95 ℃ 2 min。实时荧光定量PCR采用针对CDV核蛋白基因设计的引物[16]:CDV-83F(5'-AGCTA-GTTTCATCTTAACTATCAAATT-3')和CDV-83R(5'- TTAACTCTCCAGAAAACTCATGC-3')。引物由苏州金唯智生物技术有限公司合成。实时荧光定量PCR反应体系共20 μL,其中含5 μL样本cDNA模板(同时设置空白对照和阳性质粒对照)、10 μmol/L上下游引物各0.2 μL、2×SYBR Premix 10 μL和ROX(50×)0.4 μL。在PCR仪中95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸31 s(采集信号),进行40个循环,绘制熔解曲线。测得各样本循环阈值(cycle threshold,Ct),根据标准曲线公式计算样本中的病毒载量(拷贝数/μL)。
1.4 免疫组织化学法检测
病死猴的肺组织制成冰冻切片,并于室温干燥约40 min,然后浸泡在冷丙酮中20 min,取出后室温干燥40 min,用PBS洗涤3次,每次1 min。实验组和空白对照组分别滴加体积稀释比例为1∶50的抗CDV单抗和PBS,两组同时进行以下操作:室温孵育60 min,然后用PBS洗涤3次,每次1 min;再滴加体积比3%的过氧化氢,室温孵育10 min,而后再次PBS洗涤3次,每次1 min;滴加辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温孵育20 min,然后用PBS洗涤3次,每次1 min;滴加DAB显色剂染色3~10 min,流水冲洗10 min,去除切片上多余的水分,将切片依次浸入95%乙醇溶液、无水乙醇、环保透明剂中各2次,每次1 min,最后封固,镜检。
1.5 皮肤组织中病毒分离
将病死猴皮肤置于适量无菌生理盐水中,用无菌剪刀剪碎后研磨。研磨后的样本过筛,收集滤液并用PBS稀释至2 mL。随后以4 000×g离心5 min,获得上清液,通过0.22 μm滤膜过滤。取500 μL组织滤液接种于培养的单层MDCK细胞系中作为实验组,未接种组织滤液的单层MDCK细胞系作为空白对照组,两组同时进行以下操作:37 ℃吸附1 h后,用PBS清洗细胞1次,再加入含2%胎牛血清的DMEM维持培养基,在37 ℃、5% CO2条件下培养。此后每天观察细胞,直到出现细胞病变效应(cytopathic effect,CPE)。实验组在第8天时收集分离到的病毒,进行CDV特异性PCR验证,方法同1.3节。
1.6 病毒分离株的测序及遗传进化分析
取表现有细胞病变效应的MDCK细胞培养液,3 000×g离心5 min,取上清液20 μL加入5 mL聚乙二醇 6000混匀,4 ℃存放24 h,10 000×g离心20 min,取沉淀用DPBS重悬。重悬液送上海探普生物科技有限公司进行全基因组测序。用NovaSeq 6000(Illumina)测序仪测序,用SPAdes v3.13.0工具对病毒基因组进行组装,并将整个开放阅读框序列存放入美国国家生物技术信息中心管理的GenBank中。采用Clustal Omega工具对不同CDV分离株进行多序列比对和核苷酸百分比同源性计算,用Seaview 5.02[17]和PhyML v3.1[18]算法构建遗传发育树,并对其进行遗传进化分析。
2 结果
2.1 病毒感染食蟹猴的临床症状及剖检情况
图1
图1
患病食蟹猴的临床体征
Figure 1
Clinical symptoms of the infected cynomolgus monkeys
2.2 患病猴与病死猴送检样本中均检测出CDV核蛋白基因片段
使用CDV特异性引物对21只患病猴和1只病死猴的送检样本进行实时荧光定量PCR检测,结果显示,在21只患病猴血清、红疹拭子样本及1只病死猴的全血、皮肤、肺和肝脏组织中均成功扩增出CDV的核蛋白基因片段,即PCR结果全为阳性,其中1只病死猴全血、皮肤、肺和肝脏组织的Ct值分别为36.4、16.1、17.7和24.9,病毒载量分别为1.4 拷贝/μL、4.8×105拷贝/μL、1.7×105拷贝/μL和2.0×103拷贝/μL,说明病死猴皮肤中的病毒载量最高。
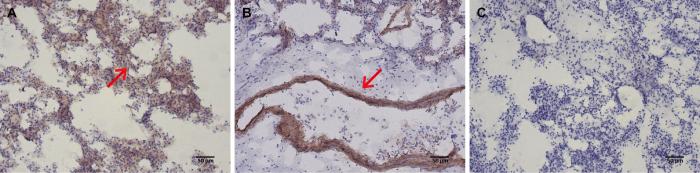
2.3 病死猴肺组织中检测出CDV核蛋白
使用针对CDV核蛋白的抗体对病死猴的肺组织进行免疫组织化学染色,结果显示在肺泡上皮细胞、支气管和细支气管处均出现棕褐色的特异性染色反应(图2),提示病死猴的肺组织中有明显的CDV感染。
图2
图2
免疫组织化学染色法检测病死猴肺组织切片中病毒蛋白表达(DAB染色,×100)
Figure 2
Detection of viral protein expression in lung tissue sections of the deceased monkey by immunohistochemical staining (DAB staining, ×100)
2.4 病死猴皮肤组织中分离出CDV
图3
图3
病死猴皮肤组织滤液接种MDCK细胞后的病毒感染细胞病变效应表现
Figure 3
Observation of cytopathic effect after inoculation of MDCK cells with skin tissue filtrate from the deceased monkey
2.5 CDV分离株测序及遗传进化分析显示其是野生型病毒株
病毒株CDV/CYN/SUZ/2020分离自病死猴的皮肤组织,全基因组长度为15.67 kb。其完整核苷酸序列存入GenBank中,登录号为MT325867。该分离株的全长开放阅读框核苷酸序列是亚洲地区具有代表性的CDV株之一。将其核苷酸序列与亚洲地区常见的病毒株进行比对,结果(表1)显示:新分离的CDV/CYN/SUZ/2020株与在越南发现的CDV/dog/HCM/33/140816株[19]的同源性最高,为98.86%;与中国发现的水貂ZC1310M株也有98.44%的一致性,但与水貂CDV 3株(疫苗株)的匹配度较低(92.14%),表明此次新发现的食蟹猴CDV株并非来源于疫苗株,而是野生型病毒株。另外,与其他实验猴中分离的CDV病毒株相比,CDV/CYN/SUZ/2020株与BJ-01株[2]和CYN07-dV株[10]有97.05%的相似性,与MKY-KM08株[2]的相似度为96.93%。
表1 病死猴皮肤组织中分离的CDV株全长开放阅读框核苷酸序列与亚洲常见CDV株的一致性(相似度)比对 (%)
Table 1
病毒株 Strains | CDV/CYN/SUZ/2020 | CDV/dog/HCM/33/140816 | ZC1310M | CYN07-dV | BJ-01 | MKY-KM08 | CDV1_TH/2014 | MCL-18-Li-1/1 | 007Lm | CDV3 |
|---|---|---|---|---|---|---|---|---|---|---|
| CDV/CYN/SUZ/2020 | 100.00 | - | - | - | - | - | - | - | - | - |
| CDV/dog/HCM/33/140816 | 98.86 | 100.00 | - | - | - | - | - | - | - | - |
| ZC1310M | 98.44 | 98.73 | 100.00 | - | - | - | - | - | - | - |
| CYN07-dV | 97.05 | 97.31 | 97.70 | 100.00 | - | - | - | - | - | - |
| BJ-01 | 97.05 | 97.30 | 97.69 | 99.92 | 100.00 | - | - | - | - | - |
| MKY-KM08 | 96.93 | 97.18 | 97.56 | 99.64 | 99.64 | 100.00 | - | - | - | - |
| CDV1_TH/2014 | 94.28 | 94.54 | 94.84 | 94.62 | 94.61 | 94.57 | 100.00 | - | - | - |
| MCL-18-Li-1/1 | 93.54 | 93.78 | 94.11 | 93.87 | 93.87 | 93.82 | 94.06 | 100.00 | - | - |
| 007Lm | 93.93 | 94.25 | 94.57 | 94.53 | 94.51 | 94.46 | 94.57 | 93.95 | 100.00 | - |
| CDV3 | 92.14 | 92.37 | 92.68 | 92.43 | 92.42 | 92.43 | 92.34 | 91.96 | 92.76 | 100.00 |
在系统发育分析中,虽然新鉴定的CDV/CYN/SUZ/2020株属于亚洲1型遗传谱系(图4),但它与2006年广西犬瘟热恒河猴中分离的CDV株以及2008年北京犬瘟热恒河猴病例中发现的病毒株均不相同,与2008年日本食蟹猴感染病例中的病毒株也不相同。
图4
图4
基于不同CDV株全开放阅读框序列的系统发育分析(黑框标记的为本研究从病死猴皮肤组织中新分离的CDV株)
Figure 4
Phylogenetic analysis based on full-length open reading frame sequences of different CDV strains (the CDV strain newly isolated from the skin tissue of the deceased monkey in this study is marked with a black box)
3 讨论
有历史文献记载表明,CDV在1760年通过犬类传入欧洲某地,并引发了广泛流行,感染后的动物死亡率很高,最终传播到欧洲的其他地区[20-21]。CDV和MeV均属于麻疹病毒属,具有相同的基因组结构,并有高度相似的核苷酸和氨基酸序列。有研究表明,CDV可能曾感染过人类,与一种人类神经性疾病——多发性硬化症(multiple sclerosis,MS)存在某种关联[3]。基于CDV和MeV在分子层面上的相关性,科学家们可以用CDV来研究麻疹的发病机制,并且开发疫苗和抗病毒疗法。尽管CDV具有宿主特异性,主要感染犬科动物,但它仍对包括非人灵长类在内的多种动物构成威胁。目前,国内外已有多起CDV感染非人灵长类动物的报道,且一旦感染,没有疫苗的保护,其发病率较高。接种MeV疫苗的动物通常也会对CDV产生免疫反应,所产生的抗体能够识别MeV和CDV之间保守的表位,从而为宿主提供一定程度的保护[22-23]。因此推测,MeV免疫可能保护人类免受CDV感染,或至少使感染者未表现出临床症状。在感染CDV并接种MeV疫苗的非人灵长类动物模型中,动物产生的抗体可对CDV产生部分交叉反应,提供了一定的交叉保护[24]。此外有文献报道,抗CDV血清治疗有助于促进CDV感染动物的康复[11]。目前,已有CDV肽作为候选疫苗的研制报道,未来将有更为成熟的CDV疫苗产生[25]。
本研究中,对患病猴和病死猴的临床标本进行实验室调查符合科赫法则[10],本实验室的检测结果和动物表现出的典型临床症状共同证明了CDV是导致该猴群疾病暴发的主要原因。本研究不仅进行了CDV的核酸检测,还检测了CDV抗体以及会导致皮疹的猴水痘病毒(simian varicella virus,SVV)、MeV的核酸及其抗体。结果显示,患病猴血清中的CDV和MeV抗体检测均为阳性,而SVV核酸、抗体以及MeV的核酸检测均为阴性,进一步说明了CDV与MeV抗体之间的交叉反应。
本单位为实验动物第三方检测机构。回溯本单位在2020年6月至2024年6月针对CDV的全部检测数据显示:3 414份实验猴血清样本中CDV抗体的总检出率为44.11%(1 506/3 414),其中食蟹猴的CDV抗体检出率为53.88%(903/1 676),恒河猴为37.14%(361/972),豚尾猴为31.54%(241/764);11 333份全血、口腔/鼻拭子、粪便、肺组织等样本中CDV核酸的检出率为1.92%(218/11 333),其中食蟹猴为1.05%(76/7 268),恒河猴为3.49%(142/4 073)。可以看出,CDV抗体的阳性率远高于核酸阳性率。这可能是因为近年来随着各单位对CDV感染非人灵长类动物的认识和了解,加强了预防与监测工作,部分动物接种了犬瘟热疫苗,另外部分猴群接种了麻疹疫苗,而这都会使动物产生与CDV抗原的交叉反应。因此,与抗体检测结果相比,核酸检测的阳性率更能反映猴群的实际感染情况。在本案例中,共有26只食蟹猴发病,其中8只死亡;在得知检测结果后,该猴场迅速对患病动物及与其有接触的可疑动物进行了隔离(总计约200只),并对隔离动物接种了CDV疫苗。此后,该猴场出现类似CDV感染症状的实验猴大幅减少,未发现新病例,也无新增死亡动物。鉴于此,笔者建议将CDV纳入猴群的日常监测计划中。
本研究对华南地区某养殖猴场发现CDV感染症状的21只患病猴的血清、皮肤红疹拭子以及1只病死猴的全血、皮肤、肺、肝脏样本进行CDV核蛋白基因特异性实时荧光定量PCR扩增,结果均为CDV阳性。随后,采用免疫组织化学染色技术检测肺组织中的CDV抗原,发现肺泡上皮细胞、支气管和细支气管处聚集了大量的CDV核蛋白抗原。最后,成功从CDV阳性病死猴的皮肤组织中分离出CDV株并进行了全基因组测序,构建了遗传发育树。遗传进化分析发现,新分离的CDV/CYN/SUZ/2020病毒株与其他已知的亚洲1型、亚洲2型和CDV疫苗株存在差异,但与2014年越南发现的CDV/dog/HCM/33/140816病毒株相似度最高;而越南发现的CDV株与中国河北发现的KC427278.1株亲缘关系最接近[19],这提示CDV的跨境传播可能发生在中国和越南之间。随后该猴场证实,此批食蟹猴确实是在CDV暴发感染的同年从越南引进。笔者认为,广泛研究来自中国不同地区及不同动物种属的CDV分离株,将有助于更好地了解中国CDV感染情况,特别是非人灵长类动物CDV的起源和演变,同时为CDV的诊断、疫苗研发和疾病防控提供重要支持。
[引用本文]
王晨娟, 杨玲焰, 王立鹏, 等. 2019年某实验猴养殖场食蟹猴犬瘟热暴发 的 诊 断 [J]. 实 验 动 物 与 比 较 医 学 , 2025, 45(3): 360-367. DOI:10.12300/j.issn.1674-5817.2024.160.
WANG C J, YANG L Y, WANG L P, et al. Diagnosis of an outbreakof canine distemper in cynomolgus monkeys in an experimentalmonkey farm in 2019[J]. Lab Anim Comp Med, 2025, 45(3): 360-367.DOI: 10.12300/j.issn.1674-5817.2024.160.
作者贡献声明
王晨娟负责临床样本收集、检测和结果分析,以及文献检索与论文撰写;
杨玲焰负责病毒分离培养和论文修改;
王立鹏负责PCR检测及数据整理;
孙雪萍负责免疫组织化学染色实验及分析;
李静文负责血清学检测;
郭连香、荣荣指导论文修改,参与论文审核;
时长军指导实验设计,负责论文审核。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Detection and molecular characterization of canine distemper virus in wildlife from northern Italy
[J].
Natural infection with canine distemper virus in hand-feeding Rhesus monkeys in China
[J].
Evolution and interspecies transmission of canine distemper virus-an outlook of the diverse evolutionary landscapes of a multi-host virus
[J].
Canine distemper virus in wildlife in south-western Europe
[J].
Prevalence of canine distemper in minks, foxes and raccoon dogs from 1983 to 2023 in Asia, North America, South America and Europe
[J].
Isolation and sequence analysis of a canine distemper virus from a raccoon dog in Jilin Province, China
[J].
Canine distemper virus in endangered species: species jump, clinical variations, and vaccination
[J].
Molecular detection and phylogenetic analysis of canine distemper virus in marsican brown bear (Ursus arctos marsicanus)
[J].
Unveiling the molecular epidemiology of canine distemper virus in Namibia: an expected pathogen showing an unexpected origin
[J].
Lethal canine distemper virus outbreak in cynomolgus monkeys in Japan in 2008
[J].
Canine distemper outbreak in rhesus monkeys, China
[J].
Natural infection with canine distemper virus in a Japanese monkey (Macaca fuscata)
[J].
灵长类动物感染犬瘟热
[J].
Natural infection with canine distemper virus in Primates
[J].
犬瘟热病毒的分离鉴定及其抗原蛋白的研究
[D].
Isolation and identification of canine distemper virus and study on its antigenic protein
[D].
SYBR GreenⅠ荧光定量RT-PCR检测犬瘟热病毒方法的建立及应用
[J].
Development of a SYBR GreenⅠ real-time RT-PCR assay for detection of canine distemper virus
[J].
SeaView version 4: a multiplatform graphical user interface for sequence alignment and phylogenetic tree building
[J].
A simple, fast, and accurate algorithm to estimate large phylogenies by maximum likelihood
[J].
Isolation and phylogenetic analysis of canine distemper virus among domestic dogs in Vietnam
[J].
Origin of canine distemper virus: consolidating evidence to understand potential zoonoses
[J].
Canine distemper virus: origins, mutations, diagnosis, and epidemiology in Mexico
[J].
The antigenic relationship between measles, canine distemper and rinderpest viruses studied with monoclonal antibodies
[J].
A chimeric measles virus with canine distemper envelope protects ferrets from lethal distemper challenge
[J].
Canine distemper virus with the intact C protein has the potential to replicate in human epithelial cells by using human nectin4 as a receptor
[J].
Universal peptide-based potential vaccine design against canine distemper virus (CDV) using a vaccinomic approach
[J].
Isolation and phylogenetic characterization of Canine distemper virus from India
[J].
Biomolecular analysis of canine distemper virus strains in two domestic ferrets (Mustela Putorius furo)
[J].
Genotypes of canine distemper virus determined by analysis of the hemagglutinin genes of recent isolates from dogs in Japan
[J].
Insight into an outbreak of canine distemper virus infection in masked palm civets in China
[J].