酪氨酸酶(tyrosinase,TYR)和MC1R是调控毛色的两个重要基因。TYR是酪氨酸酶相关蛋白家族成员之一,酪氨酸酶是黑色素合成过程中的限速酶,TYR表达量及活性的高低直接影响真黑素与褐黑素的表达,进而对动物毛色产生影响。TYR由5个外显子和4个内含子组成,其编码区(coding sequence,CDS)为1 593 bp。MC1R是黑色素细胞中的G蛋白偶联受体,主要参与黑色素类型与数量的调控,导致真黑色素(黑色或棕色色素)或褐黑色素(红色或黄色)的产生。MC1R基因有1个外显子,其CDS为951 bp。2018年,Yu等[4]检测了野生色、白棕斑块色及白色3种被毛豚鼠的TYR基因多态性,发现白色豚鼠TYR基因外显子I区域呈A→G点突变。同年,Vidal[5]发现,白色伴有棕色、棕黑色和黑色斑块3种被毛的豚鼠MC1R基因序列缺失多态性与毛色有关。国内赖伟宁等[6]还报告,黄毛色豚鼠的MC1R基因在603 260~606 019 bp处缺失一段2 760 bp的序列,其中包括CDS区域。在上述文献基础上,本研究拟通过对本课题组培育的3种毛色即白色、花色及黑色豚鼠的TYR和MC1R毛色基因CDS多态性及RNA表达量分析,探讨豚鼠毛色基因多态性和表达量在调控豚鼠毛色中的作用,以期为研究豚鼠毛色基因相关性状提供遗传标志。
1 材料与方法
1.1 实验动物
由中国医学科学院引进的白色豚鼠,与浙江大学实验动物中心原先饲养的花色豚鼠杂交,然后通过近亲繁殖11代,分离出白色、黑色和花色3种毛色群体。每个毛色群体再以封闭形式远交繁殖4代以上,最后形成3个远交群。将白色豚鼠命名为Zmu-1∶DHP品种,黑色豚鼠命名为Zmu-2∶DHP品种,花色豚鼠命名为DHP品种。本实验取Zmu-1∶DHP白色豚鼠22只,DHP花色豚鼠22只,Zmu-2∶DHP黑色豚鼠13只,体重约300~400 g,性别不论。所有动物均来自浙江宏润生物科技有限公司[SCXK(浙)2022-0010],质量合格证号为20240315Cddz0600999173。所有豚鼠毛色表型见图1。
图1
图1
白色(A)、花色(B)和黑色(C)豚鼠的毛色表型
Figure 1
White (A), variegated (B), and black (C) coat-color phenotypes of the guinea pigs
1.2 试剂及仪器
DNA提取试剂盒(Code No.9765)、RNA提取试剂盒(Code No.9767)、RNA反转录试剂盒(Code No. RR037Q)和SYBR Green荧光定量PCR染料(Code No. RR820Q)均购自日本TaKaRa公司,2×Hieff@PCR预混液(Yeasen 10157)购自翌圣生物科技(上海)股份有限公司。DNA测序试剂BigDye3.1、5×测序缓冲液和高度去离子(Hi-Di)甲酰胺购自美国Applied Biosystems公司,虾碱酶(shrimp alkaline phosphatase,SAP)购自美国Promega公司,外切酶ExoⅠ购自美国Epicentre公司。2720型PCR仪和3730XL型测序仪均购自美国Applied Biosystems公司,CFX-96荧光定量PCR检测仪、Gene Pluser Xcell型电泳仪和GelDoc XR(170-8170)型凝胶图像仪均购自美国Bio-Rad公司,Nano-Drop分光光度计购自美国Thermo公司。
1.3 皮肤组织取样
动物实验在浙江中医药大学动物实验研究中心[SYXK(浙)2021-0012]的豚鼠饲养室进行,普通级环境,相对湿度为40%~70%,室温保持在22~26 ℃,昼夜时长12/12 h。动物实验方案经浙江中医药大学实验动物管理与伦理委员会审查批准(IACUC-202305-11)。整个动物饲养及实验操作过程均按照中国动物伦理福利相关标准执行。获取实验材料前,先用过量戊巴比妥钠麻醉对豚鼠施行安乐死,然后剪取其背部直径为1.5 cm的皮肤,置于2 mL试管内,迅速放入液氮。等所有皮肤组织样本取完后,放置于-85 ℃冰箱保存。
1.4 DNA、RNA提取及RNA反转录
分别用DNA和RNA提取试剂盒,按照说明书提取豚鼠皮肤组织中DNA及RNA,然后电泳检测其质量。使用反转录试剂盒将RNA反转录成cDNA,以供后续实时荧光定量PCR检测;具体操作按照试剂盒说明书进行。
1.5 引物设计
表1 测序扩增TYR、MC1R基因编码序列的引物
Table 1
引物名称 Primer name | 引物序列(5'→3') Primer sequence (5' to 3') | 扩增片段长度/bp Length of amplified fragment/bp | 位置 Location |
|---|---|---|---|
TYR-1F1 TYR-1R1 | GCTCAAACAGAGTTTGGAAGCA AAACATGGGAGTTGATCCATTCTT | 534 | 外显子Ⅰ |
TYR-1F2 TYR-1R2 | GAGTGTCCCAGAGAAGGATAAATTC ATGAGGTGCTCTGTAAGGACAGATA | 571 | 外显子Ⅰ |
TYR-2F TYR-2R | CCTGATTATTAGAAATCAAAGCTGGTAAC AATTTAAACACAAAGTCAGGAGGAAA | 382 | 外显子Ⅱ |
TYR-3F TYR-3R | TAGTCATTTGGACTTTTATCAGGTAAACTA AATCCTACCAACTGGGTAAATTAGCATA | 387 | 外显子Ⅲ |
TYR-4F TYR-4R | ATATTATGTAGGGCACAATAGCATGAA TAGAGATAACACTCTAGAAACATAAACTT | 462 | 外显子Ⅳ |
TYR-5F TYR-5R | AAAAATTGAGATTTCCTTCTATTTCAG GATCTTCACTGACAAACAGGGATT | 365 | 外显子Ⅴ |
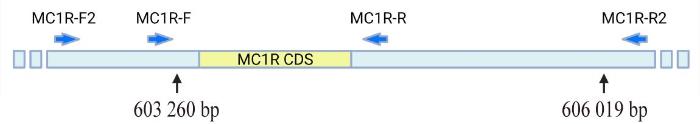
MC1R-F MC1R-R | CACTCTTGGGACCCCTGGAT TTCCTGCTTTTTGGGGTCATACTC | 1 249 | 外显子 |
MC1R-F2 MC1R-R2 | CCCCGTGATAAACAGCACAATGG TTGTGCCTCCTTTGCTTGTGTC | 3 956 or 1 196 | 外显子Ⅰ |
图2
图2
MC1R基因的引物结合位置
Figure 2
Primer binding site of MC1R gene
另外,用软件设计检测TYR、MC1R基因RNA表达量的引物序列,详见表2。
表2 PCR检测TYR、MC1R基因表达量的引物序列
Table 2
引物名称 Primer name | 引物序列(5’→3’) Primer sequence (5’ to 3’) | 扩增片段长度/bp Length of amplified fragment/bp | 位置 Location |
|---|---|---|---|
TYR-F TYR-R | TGGAACAAGCACGTCAGATCTG AGCTGCTTTCTCTTGTGATGGC | 118 | TYR编码序列Ⅴ区域 |
MC1R-F MC1R-R | TCGCCGTGGACCGCTATATCTC AGGTGATGAAGAGGGTGCTGGAG | 132 | MC1R编码序列 |
β-actin-F β-actin-R | TGTGGATCGGCGGCTCTATC GACTCATCGTACTCCTGCTTGC | 79 | β-actin |
1.6 测序分析TYR和MC1R基因多态性
利用表1所示DNA引物,分别用PCR扩增3个品种豚鼠皮肤组织中的TYR、MC1R基因,电泳检测扩增产物。然后委托上海天昊生物科技有限公司对扩增的DNA片段进行测序,使用Polyphred软件分析基因结构、单核苷酸多态性(single nucleotide polymorphism,SNP)突变点和突变区域。
1.7 实时荧光定量PCR检测TYR和MC1R基因表达
按照SYBR Premix Ex TaqTM Ⅱ荧光定量试剂盒说明书,配制下列扩增液:SYBR®Premix Ex TaqTMⅡ(2×)10 μL,20 μmol/L正反向引物各1.0 μL,Rox 0.4 μL,cDNA模板1.0 μL,DEPC处理水6.6 μL,共20 μL。引物序列见表2。模板为3种毛色豚鼠的皮肤组织cDNA。将该反应体系加到用于荧光定量反应的8联管内,用实时荧光定量PCR仪分别扩增TYR及MC1R基因,同时设置β-actin内参,灭菌双蒸水替代模板作为阴性对照组。cDNA浓度及参照组进行统一归一化。扩增反应条件:预变性95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。熔解曲线从55 ℃开始,每30 s升高0.5 ℃,直到95 ℃,循环1次。所有反应信息资料由ABI StepOnePlus PCR仪收集,循环阈值(cycle threshold,Ct)值通过计算机软件测量和计算,经公式2-△△Ct计算目的基因的相对表达量。
1.8 统计学分析
使用Chromas 2、Primer 5和DNAman 9软件进行测序结果分析;使用Cervus 3.0软件分析基因频率和基因型频率。使用SPSS 22.0软件进行统计学分析。3个毛色品种豚鼠的TYR、MC1R基因型和基因频率用百分率表示,组间比较采用卡方检验;基因表达量用平均值±标准差表示,组间比较采用单因素方差分析,组内比较采用LSD-t检验,P<0.05表示差异有统计学意义。使用GraphPad Prism 9软件制作统计图。
2 结果
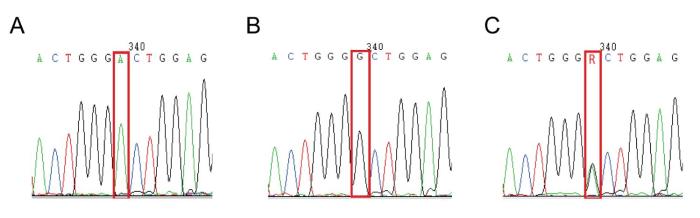
2.1 TYR基因的外显子CDS及氨基酸序列多态性
图3
图3
豚鼠TYR基因外显子I编码序列区域的SNP峰值图
Figure 3
Single nucleotide polymorphism (SNP) peak plot in the coding sequence region of TYR gene exon Ⅰ in guinea pigs
图4
图4
豚鼠TYR基因外显子I 编码序列区域的变异点氨基酸序列
Figure 4
Amino acid sequences at the mutation point in the coding sequence region of TYR gene exon Ⅰ in guinea pigs
2.2 MC1R基因的CDS序列多态性
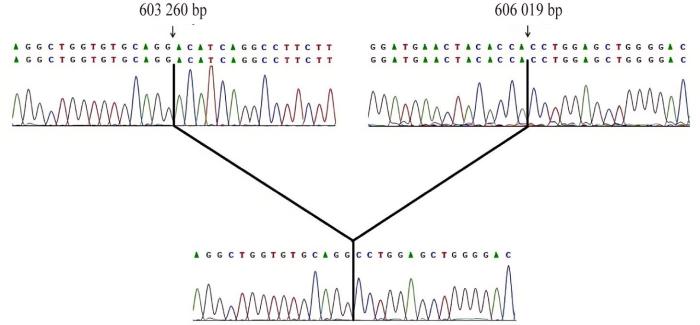
豚鼠MC1R基因外显子CDS及旁侧序列测序发现,部分个体的 MC1R基因呈现两个断裂点,分别位于第603 260 bp和606 019 bp位置,断裂点之间缺失一段DNA序列,长度为2 760 bp,其中包括CDS区域。因片段缺失而造成MC1R基因呈长度多态性,其插入序列及断裂点旁侧部分序列的峰值图见图5。
图5
图5
豚鼠MC1R基因外显子缺陷区域的峰值图
Figure 5
Peak plot of the deleted sequence region in the exon of MC1R gene in guinea pigs
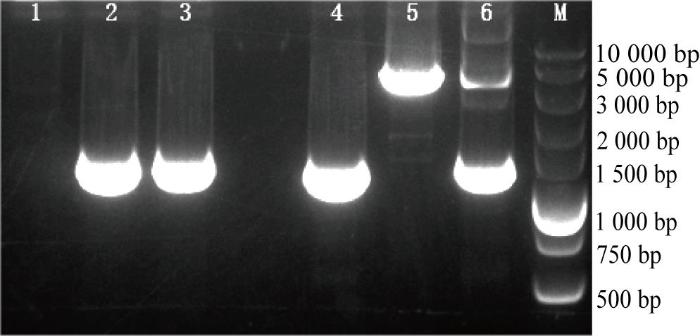
图6所示电泳图验证了MC1R序列缺失现象,可见用MC1R-F/R引物扩增野生型样本能得到1 249 bp的片段(泳道2),其单倍体基因标记为N,而突变型样本不能扩出产物(泳道1),其单倍体标记为-,泳道3为杂合型产物;用MC1R-F2/R2引物扩增野生型样本能得到3 956 bp的片段(泳道5),而突变型样本只扩出1 196 bp的片段(泳道4),泳道6为杂合型产物。因此,断定突变型比野生型缺少2 760 bp的片段。
图6
图6
豚鼠MC1R基因PCR产物电泳图
Figure 6
Electrophoretic map of PCR products of MC1R gene in guinea pigs
2.3 TYR基因的基因型及基因频率
将3种豚鼠的TYR基因变异情况统计列于表3,可见每种豚鼠基因型和基因的最高频率如下:Zmu-1∶DHP白色豚鼠的G/G基因型及G基因频率都高达100%;DHP花色豚鼠的A/A基因型为77%,A基因频率为89%;Zmu-2∶DHP黑色豚鼠的A/A基因型为85%,A基因频率为92%。因此说明白色豚鼠全部是G/G基因型,而花色及黑色豚鼠以A/A基因型为主,黑色豚鼠的A/A基因型频率又略高于花色豚鼠。随着豚鼠白色表型向黑色表型过渡,TYR等位基因由G转变至A。
表3 豚鼠TYR基因的基因型频率及基因频率
Table 3
品 种 Breed | 基因型频率(样本数) Genotypic frequency(Sample size) | 基因频率(基因数) Gene frequency(Gene count) | |||
|---|---|---|---|---|---|
| G/G | G/A | A/A | G | A | |
Zmu-1:DHP (n=22) DHP (n=22) | 1.00 (22) 0.00 (0) | 0.00 (0) 0.23 (5) | 0.00 (0) 0.77 (17) | 1.00 (44) 0.11 (5) | 0.00 (0) 0.89 (39) |
| Zmu-2:DHP (n=13) | 0.00 (0) | 0.15 (2) | 0.85 (11) | 0.08 (2) | 0.92 (24) |
2.4 MC1R基因的基因型及基因频率
将携带缺失片段的MC1R基因单倍体位点标记为-,片段未缺失的位点标记为N,则正常MC1R等位基因的基因型为N/N,一侧等位基因片段缺失的为N/-,两侧等位基因片段均缺失的为-/-。3种豚鼠的MC1R基因变异情况统计列于表4,从中可见每种豚鼠基因型和基因的最高频率如下:Zmu-1∶DHP白色豚鼠的-/-基因型频率为82%,-基因频率为89%;DHP花色豚鼠的N/-基因型为55%,-和N基因频率各为50%;Zmu-2∶DHP黑色豚鼠的N/N基因型为50%,略高于N/-基因型,N基因频率为71%。因此说明白色豚鼠以-/-基因型为主,花色豚鼠以N/-为主,黑色豚鼠以N/N为主。随着豚鼠白色向黑色表型过渡,MC1R等位基因由-转变至N。
表4 豚鼠MC1R基因的基因型频率及基因频率
Table 4
品 种 Breed | 基因型频率(样本数) Genotypic frequency(Sample size) | 基因频率(基因数) Gene frequency(Gene count) | |||
|---|---|---|---|---|---|
| -/- | -/N | N/N | - | N | |
Zmu-1:DHP (n=22) DHP (n=22) | 0.82 (18) 0.23 (5) | 0.14 (3) 0.55 (12) | 0.05 (1) 0.23 (5) | 0.89 (39) 0.50 (22) | 0.11 (5) 0.50 (22) |
| Zmu-2:DHP (n=12) | 0.08 (1) | 0.42 (5) | 0.50 (6) | 0.29 (7) | 0.71 (17) |
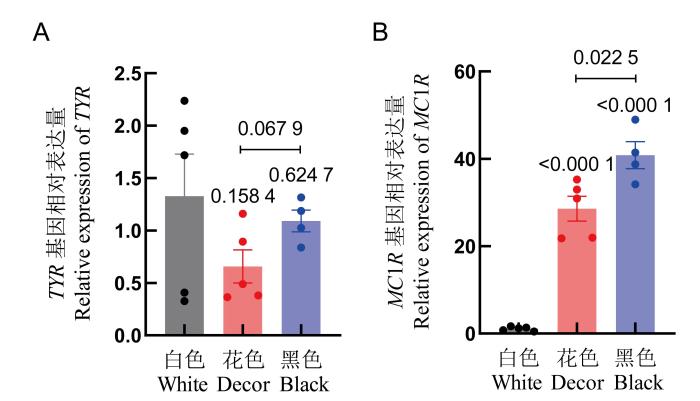
2.5 TYR和MC1R基因的RNA相对表达量
图7
图7
实时荧光定量PCR检测豚鼠TYR、MC1R基因的RNA表达量
Figure 7
RNA expression levels of TYR and MC1R genes in guinea pigs detected by real-time fluorescent quantitative PCR
3 讨论
与其他动物一样,豚鼠的毛色演变机制比较复杂。已知TYR及MC1R是调控动物毛色比较重要的基因,并且两者相互协同调控产生多种毛色。TYR是调控酪氨酸生成黑色素的限速酶,其活性高低与调控生成真黑色素还是褐黑色素,即皮毛呈黑色还是浅色有关。MC1R激活或抑制将影响TYR的表达和活性,从而调节色素深浅[7]。色素基因的多态性及活性关系黑色素产生的量及比例,能引起动物被毛的颜色深浅和斑块形成[8]。本研究检测了豚鼠TYR和MC1R基因的多态性及组织表达,结果发现:TYR基因CDSⅠ区域第710 bp点突变呈SNP,产生野生型A和白化型G两种核苷酸,所有白色被毛表型的豚鼠100%呈现G/G基因型。这说明该SNP与白化表型呈完全共分离,支持白化隐性遗传模式。该位点错义突变710A>G,Asp237Gly与豚鼠产生白化表型有关,这与Yu等[4]证明的白化豚鼠TYR基因变异结论相同。Yan等[9]认为,白化机制是A/A变异为G/G后,该位点插入了一个过早终止编码序列,导致不能合成色素来调控皮毛产生深色之故。深色被毛(花、黑)表型豚鼠的TYR基因少量呈A/G基因型,多数呈A/A基因型,而且黑色豚鼠的A/A基因型频率高于花色豚鼠,说明豚鼠毛色变成深色(花、黑)后,A基因和A/A基因型频率快速增高。因此提示,A是TYR控制深色表型的主要基因,呈显性遗传特征。
本研究还发现,MC1R基因外显子缺失2 760 bp序列,因而出现基因长度多态性。据报道,MC1R基因缺失2 760 bp片段后,将失去调控产生黑色素的功能[5],或产生黄色被毛[6]。所以,MC1R的缺失型为-/-突变型,控制产生浅色被毛;非缺失型为N/N野生型,控制产生深色被毛。这从白毛豚鼠MC1R有比较高的-/-基因型频率,深色豚鼠中的花色豚鼠以-/N基因型为主,黑色豚鼠以N/N基因型为主,-/N基因型次之可以看出。以上结果说明,随着毛色由花色变为黑色,豚鼠MC1R的N基因和N/N基因型频率逐渐增高。N基因是MC1R调控深色被毛的主要基因,呈显性遗传,而-基因呈隐性遗传。由此可见,豚鼠深色毛是TYR基因A位点及MC1R基因N位点共同调控的结果。本研究使用的豚鼠是本课题组培育品种,与文中参考文献[6]报告的豚鼠来源及遗传不同,但相同毛色豚鼠的关键毛色基因突变位点仍一致,进一步证明这些基因突变是促使毛色多样性的主要因素。
从基因表达结果来看,白色豚鼠TYR的G基因表达率较高,MC1R基因表达率极低,证明豚鼠白色被毛主要由TYR的G基因调控。深色被毛豚鼠中,TYR的G和MC1R的-基因频率降低,A和N基因频率升高,同时花色到黑色豚鼠的基因表达率增强,表现毛色逐渐变深,直至黑色,这与中国家驴深色被毛变化的情况[10]相似。然而在调控色素由浅变深的过程中,两个基因在品种间的表达水平差异很大:TYR基因表达组间P>0.05,可见其调控力较弱;而对MC1R基因来说,花色及黑色豚鼠基因表达率均极显著高于白色豚鼠(P<0.01),黑色豚鼠基因表达率又高于花色豚鼠(P<0.05),可见其调控力极强。这说明,豚鼠深色被毛以MC1R调控力较显著,TYR可能仅对每个个体深毛色起到不同程度的修饰及辅助作用,这与朱谋等[11]提出的TYR较弱、MC1R较强的结论相一致。杨永升等[12]认为,MC1R是影响黑色素合成的主效基因,该基因变异会导致不同的表型性状。本研究中个别MC1R的-/-基因型个体出现深色表型,可能是TYR的A及其他有色基因与-/-基因共同调控的结果。因此,豚鼠毛色变化与毛色基因紧密相关,毛色基因的多态性变化与个体基因表达差异等因素复合构成豚鼠多种被毛颜色,尤其还有其他毛色基因引起花色被毛的随机调和式变化。
毛色基因调控机体产生色素,包括真黑色素和褐黑色素。据文献报告,黑色素与抵抗病毒传染病有关。Manning等[13]认为,黑色素可以抑制艾滋病发生,皮肤较黑的人感染艾滋病概率显著降低。胡国斌等[14]报告,黑色素能抵抗流感病毒。鲁明等[15]阐述了黑色素的作用机制,认为黑色素在皮肤及黏膜中起到增强抵抗病毒侵入的作用,能够抑制人类免疫缺陷病毒(human immunodeficiency virus,HIV)的复制。笔者也曾发现,课题组培育的Zmu-1:DHP白色豚鼠对口蹄疫病毒极敏感,而脚爪部位伴有黑色毛的DHP花毛豚鼠则对该病毒呈抗性,说明豚鼠黑色素的增多及其产生部位对病毒的易感性至关重要。结合豚鼠病毒易感性的表型,从本文基因分析来看,TYR控制白色毛的G基因可能是豚鼠对病毒敏感及免疫力较低表型的标志基因,反之,控制有色毛的TYR的A基因和MC1R的N基因可能是抵抗病毒及免疫力较高表型的标志基因。由于表型与基因存在相关性,标志基因又可能与其他性状基因存在连锁关系,因此本研究中这些色素基因位点可作为遗传标志,为筛选豚鼠优势性状基因提供锚定位点或方向标。
[引用本文]
汤银根, 冯亚仙, 钟敏, 等. 不同毛色豚鼠的TYR及MC1R基因多态性及组织表达分析[J]. 实验动物与比较医学, 2025, 45(1): 21-29. DOI: 10.12300/j.issn.1674-5817.2024.105.
TANG Y G, FENG Y X, ZHONG M, et al. Polymorphism and tissue expression analysis of TYR and MC1R genes in guinea pigs with different coat-color phenotypes[J]. Lab Anim Comp Med, 2025, 45(1): 21-29. DOI: 10.12300/j.issn.1674-5817.2024.105.
医学伦理声明
本研究所涉及的所有动物实验均已通过浙江中医药大学实验动物管理与伦理委员会批准(终审编号:IACUC-202305-11)。所有实验过程均遵照中国实验动物相关法律法规条例要求进行。
Medical Ethics Statement
All animal experiments involved in this study were approved by Institutional Animal Care and Use Committee (IACUC) of Zhejiang Chinese Medical University (Approval Number: IACUC-202305-11). All experimental processes were conducted in accordance with the relevant laws and regulations regarding experimental animals in China.
作者贡献声明
汤银根提供资源,提出实验方案。
冯亚仙负责数据采集和统计分析;
钟敏和卫振实施分子检测,协助论文修改;
汪洌对论文的知识性内容作批评性审阅,并提供指导;
刘迪文实施方案策划、实验设计和撰写论文。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Zmu-1: DHP近交系豚鼠的培育及其分子遗传结构初步鉴定
[J].
Breeding of Zmu-1: DHP inbred strain guinea pig and preliminary analysis of molecular genetic structure of the strain
[J].
Zmu-1: DHP豚鼠部分生物学特性研究
[J].
Study on some biological characters of Zmu-1: DHP guinea pig
[J].
MC1R基因多态性与烧伤后创面感染易感性及免疫功能的关联
[J].
Association between MC1R gene polymorphism and susceptibility to burn wound infection and immune function
[J].
Conserved aspartate-to-glycine mutation in tyrosinase is associated with albino phenotype in domestic guinea pigs (Cavia porcellus)
[J].
Deleterious mutations of MC1R in guinea pig
[J].
MC1R基因多态性与豚鼠隐性黄毛色的相关性分析
[J].
Association analysis of polymorphism of MC1R gene with recessive yellow-coated color in Cavia porcellus
[J].
武定乌骨鸡MC1R基因多态性与黑色素沉积的关联研究
[J].
The association between MC1R gene polymorphism and melanin deposition in Wuding silky fowl
[J].
水貂酪氨酸酶(TYR)基因克隆、SNPs筛查及其皮肤组织mRNA差异表达分析
[J].
Cloning,SNPs screening and mRNA differential expression analysis of TYR gene in skin of mink (Neovison vison)
[J].
A single base insertion in the tyrosinase gene is associated with albino phenotype in silver foxes (Vulpes vulpes)
[J].
中国家驴TYRP1基因第二内含子多态性分析
[J].
Analysis of polymorphisms in the second intron of TYRP1 gene of Chinese domestic donkeys
[J].
鸭色素合成相关基因TYR外显子1单核苷酸多态性及其与羽色性状相关性分析
[J].
Association between single nucleotide polymorphisms of first exon of the melanogenic-related TYR gene and the plumage color traits of ducks
[J].
MC1R是控制鸡黑色素形成的候选主效基因
[J].
MC1R is the candidate gene regulating melanin synthesis in chicken
[J].
Melanin and HIV in sub-Saharan Africa
[J].
黑色素抑制流感病毒诱导宿主细胞凋亡
[J].
Studies on Inhibitory Effect of Melanin on the Apoptosis
Induced by Influenza Virus in Host Cells
[J].
天然黑色素提取与生物功能研究进展
[J].
Research progress of natural melanin extraction and its biological function
[J].