传统的二维(two dimension,2D)共培养模型虽常用于研究细胞间相互作用及微环境效应,但由于其缺乏3D结构和复杂的细胞外基质,难以准确模拟体内的生理环境[11]。为克服这一局限,类器官共培养模型应运而生。在3D环境中将类器官与免疫细胞(immunocyte,IC)、基质细胞(stromal cell,StC)、微生物或多体系细胞等共培养,构建类器官共培养模型,能够更真实地模拟体内复杂细胞间通信和信号传导网络,更准确地反映机体生理和病理状态[12]。该模型在肿瘤微环境研究、免疫治疗评估、感染机制解析、药物筛选和再生医学等领域均显示出巨大的应用潜力,因此,在生物医学研究中得以占据重要的前沿地位[13]。
1 类器官共培养模型的构建
类器官共培养模型通过将类器官与IC、StC及微生物等进行共培养,创建了不同细胞相互作用的创新平台(图1)。首先,类器官与IC的共培养能够精准模拟肿瘤微环境(tumor microenvironment,TME)中的免疫反应,尤其是在与T细胞和自然杀伤(natural killer,NK)细胞等免疫效应细胞的相互作用中,有助于深入解析肿瘤免疫逃逸机制,并为个体化免疫治疗的发展奠定实验基础[16]。StC在类器官发育、功能维持和微环境重塑中起着关键作用,类器官与StC的共培养不仅通过提供生物力学支持调控类器官的生长和分化,还能够更精确地模拟组织纤维化等病理过程[17]。此外,类器官与微生物的共培养模型构建了研究宿主-微生物相互作用的新平台,通过模拟肠道屏障功能来揭示病原微生物的感染机制,为研究炎症性肠病、感染性疾病及癌症等提供了重要的研究工具和新视角[18]。为了进一步提升模拟复杂生理环境的能力,研究者将微流控技术与类器官共培养模型相结合。微流控芯片不仅能够精确控制流体动力学参数和培养条件,还可实现多种细胞类型的共培养,从而显著提升药物筛选的效率与精确度,为精准医疗和组织修复等开辟了新的研究方向[19-20]。综上,类器官与不同细胞类型及技术的深度整合,显著拓宽了其在生物医学研究中的应用前景,为解决肿瘤免疫逃逸、代谢紊乱及感染防御等复杂问题提供了重要的研究平台。
图1
图1
类器官共培养模型的构建示意图
Figure 1
Schematic illustration of the construction of an organoid co-culture model
2 类器官共培养模型的应用
相较于传统类器官模型,类器官共培养模型的应用主要体现为通过构建具有细胞互作功能的体外疾病模型,并基于此开展疾病机制研究、药物筛选、新药评价以及临床治疗预测等研究。
2.1 疾病机制研究
2.1.1 癌症
癌症研究中,类器官共培养模型在揭示TME和免疫逃逸机制方面发挥了关键作用。通过模拟TME中细胞间的复杂相互作用,为理解癌症的发生、转移、耐药性形成和免疫逃逸机制等提供了更接近生理状态的实验平台[21-22]。例如,有研究利用胰腺癌类器官与巨噬细胞共培养构建模型,揭示了巨噬细胞C-C基序趋化因子配体5(C-C motif chemokine ligand 5,CCL5)-特异性蛋白1(specificity protein 1,SP1)-双调蛋白(amphiregulin,AREG)反馈环通过激活C-C趋化因子受体5(C-C chemokine receptor type 5,CCR5)/Akt[即蛋白激酶B(protein kinase B,PKB)]/SP1/分化簇44(cluster of differentiation 44,CD44)通路,赋予胰腺癌细胞干性特征,从而促使其对吉西他滨(gemcitabine)耐药[23],该发现为理解胰腺癌耐药机制提供了新的视角。尽管当前该模型在血管模拟和动态环境再现方面仍存在一些局限,但其在揭示癌症机制、研究肿瘤细胞相互作用中具有独特价值[24]。
2.1.2 感染性疾病
类器官共培养模型在揭示病原体感染机制和宿主免疫反应中取得了重要进展。通过将类器官与病原体或IC共同培养,研究者能够模拟人体感染过程,并深入分析细胞间的相互作用[25]。有研究将沙门菌(Salmonella)通过显微注射方法注入类器官构建共培养模型,用于模拟肠道感染,从而能够直接观察病原体与初级上皮细胞的相互作用,并研究α-防御素抗菌肽对细菌生长的影响[26]。在病毒研究方面,类器官模型展现了广泛的应用潜力。以严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)为例,在类器官与SARS-CoV-2的共培养模型中发现,SARS-CoV-2感染后类器官模型表现出强烈的趋化因子诱导,这与新型冠状病毒感染患者的体内情况一致[27],表明类器官共培养模型可以作为一种可靠的疾病模型,用于病毒感染研究。这一技术为新型抗病毒药物和疫苗的研发提供了有力支撑,进而提升了感染性疾病的治疗效果。
2.1.3 神经系统疾病
在神经系统疾病的研究领域,类器官共培养模型助力于在体外构建更加可靠的神经类器官模型,用于解析人类中枢神经系统发育机制、疾病进程及其转化应用等[28]。例如,在阿尔茨海默病(Alzheimer's disease,AD)研究中,通过构建脑类器官共培养模型,揭示了神经元和星形胶质细胞中载脂蛋白E4(apolipoprotein E4,ApoE4)对微管结合蛋白病理学改变的本质,表明类器官共培养模型是作为AD研究和药物发现的一种有价值的病理模型[29]。此外,在帕金森病(Parkinson's disease,PD)的研究中,神经元与星形胶质细胞的共培养揭示了溶酶体蛋白水解受损,导致晚期糖基化终末产物(advanced glycation end product)积累与α-突触核蛋白(α-synuclein,α-syn)磷酸化增加,进一步由蛋白质去糖化酶功能丧失而引发早发性PD的发展[30]。以上研究表明,类器官共培养模型为神经系统疾病的药物开发提供了新的方向。
2.2 药物筛选与治疗评估
类器官共培养模型因其能够高度模拟体内组织的3D结构和微环境,被广泛认为是预测药物反应、毒性和不良反应的理想工具。首先,该模型来源于患者组织,保留了个体的遗传背景和细胞特性,使其在个性化药物反应预测中展现出显著优势。其次,与传统的2D细胞培养相比较,类器官更贴近人体真实的生理状态,能够反映复杂的细胞间相互作用和动态微环境[31],从而更精确地预测药物的疗效及毒性。
此外,类器官的多器官建模能力(如肝脏、肾脏、肠道类器官)为研究药物在不同组织间的代谢、特定细胞毒性的检测及长期不良反应的评估提供了强有力的工具。通过结合成簇规律间隔短回文重复(clustered regularly interspaced short palindromic repeat,CRISPR)基因编辑和高通量筛选技术,类器官共培养模型能够加速药物研发进程。2024年的一项研究中,研究人员开发了一种新型抗体#84.7,并与一种名为EBET的溴结构域和外末端蛋白降解剂进行偶联,利用类器官和IC、StC共培养模型,结合微流控技术实现高通量药物筛选,为预测肿瘤患者的药物治疗反应提供了高效便捷的新型平台[32]。2021年,研究人员基于肿瘤表面抗原谱,制备了靶向MUC1的第二代CAR-T细胞,并与类器官模型进行共培养,评估CAR-T细胞疗法在膀胱癌患者中的疗效,为制定个体化免疫治疗方案提供了实验依据[33]。在中国,利用肿瘤类器官免疫共培养模型,对齐鲁制药自主研发的新一代抗肿瘤药物IM83嵌合抗原受体T细胞注射液进行了药效评价,并获得了国家药品监督管理局的药物临床试验许可。这种将类器官共培养技术和高通量筛选技术相结合的方法,为精准医疗中的靶向药物开发提供了强有力的工具,显著缩短了药物开发周期。此外,类器官模型在其他免疫治疗如疫苗开发和免疫检查点抑制剂(immune checkpoint inhibitors)的评估中同样表现出色,进一步推动了个体化免疫治疗的发展。
3 类器官共培养模型与实验动物模型
在生物医学研究中,模型的选择对实验结果的可靠性和可重复性至关重要。类器官共培养模型作为一种新兴工具,与传统的实验动物模型在多个关键维度上存在显著差异,这些差异不仅影响实验设计,还直接关系到研究结果的适用性和科学价值。深入理解这两种模型的特征及其优缺点,对于研究人员在实验设计和结果解释中做出合理选择至关重要。
3.1 两种模型的多维度比较
其次,在伦理考量方面,类器官共培养模型因不涉及活体动物而在伦理上更易被接受[39],并符合动物福利的“替代、减少、优化(replacement,reduction,refinement, 3R)”原则,减少了对实验动物的依赖。相比之下,实验动物的使用须严格遵守动物福利伦理相关要求、法规[40],接受严格的伦理审查,这增加了研究的复杂性,并引发社会公众对动物实验必要性的质疑。因此,开发和使用类器官模型不仅能够满足科学研究需求,而且能减少相关伦理争议的风险。此外,类器官共培养模型的实验周期显著短于动物模型,使研究人员能够在较短时间内获得实验数据,从而加速科研进程[41]。同时,基于类器官共培养芯片和新兴的生物技术,研究人员可在短时间内实现高通量药物筛选。相对而言,构建动物模型周期较长,获取实验结果往往需要数周甚至数月,这不仅延缓了研究的进展,还增加了研究的成本。因此,快速的实验反馈是类器官共培养模型的一大优势。尽管类器官模型在以上方面展现出众多优势,但在生理相关性上依然存在不足。由于类器官缺乏完整生物体所具有的全身系统调节和复杂生物反应,在研究系统性疾病时,其应用受到限制。相比之下,动物模型在生理相关性研究等方面具有不可替代的优势,动物模型能够全面反映全身生理状态及疾病机制[42],为药物代谢和毒性评估等提供重要依据。因此,尽管类器官模型在技术上具有诸多优势,但在研究的全面性和深度上,动物模型仍然是不可或缺的工具。
最后,在研究范围方面和疾病建模方面,类器官共培养模型主要适用于细胞层面和局部组织微环境的研究,为个体化医疗、药物筛选、再生医学和基因治疗等方向的研究提供了强有力的工具[43]。然而,动物模型能够综合考虑生理、行为及其在疾病中的相互作用,是基础医学和临床研究中不可或缺的组成部分,但是受限于物种差异问题,动物模型的使用也存在一定的局限性。因此,选择适当的模型对于实现不同研究目标至关重要。
总体而言,类器官共培养模型与动物模型各有优势和局限(表1)。在复杂性、伦理考量和时间成本等方面,类器官共培养模型表现出显著优势,但在生理相关性和研究范围上,动物模型仍具有不可替代的重要性。因此,未来的研究应致力于优化类器官模型的生理相关性,并探索其在更广泛领域的应用,以推动新药开发和疾病研究领域的进展。
表1 类器官共培养模型与实验动物模型的多维度比较
Table 1
比较维度 Comparison dimension | 类器官共培养模型 Organoid co-culture model | 实验动物模型 Laboratory animal model |
|---|---|---|
复杂性 Complexity | 低:可控的细胞组成和环境 | 高:系统的生物复杂性 |
伦理问题 Ethical issues | 较少:不涉及活体动物 | 较多:动物实验伦理问题 |
时间成本 Time cost | 较短:快速获取结果 | 较长:动物的生长与繁殖 |
生理相关性 Physiological relevance | 较低:缺乏全身系统 | 高:能反映全身生理状态 |
研究范围 Scope of research | 细胞和局部微环境的研究 | 全身生理和行为的研究 |
疾病建模 Disease modeling | 对人类特异性疾病建模具有高度准确性 | 受物种差异限制 |
药物测试 Drug testing | 精确测试人类特异性的药物反应;高通量 | 全身药代动力学数据 |
3.2 类器官共培养模型的实验动物替代价值
3.2.1 对实验动物科学的挑战与推动
类器官共培养模型通过重建人类特异性的疾病微环境,能够显著减少实验动物的使用,在肿瘤免疫研究和药物筛选等领域展现出显著优势。该模型在一些肿瘤免疫研究和早期药物筛选中,可作为实验动物的补充工具,减少所需样本量并提高实验效率。尽管类器官模型在局部机制研究中表现出不俗的优越性,但其缺乏全身生理系统的动态调控能力,因此在多器官交互和全身疾病反应研究中仍需依赖动物模型。这种局限性表明,目前类器官模型无法完全取代动物模型,而是作为重要补充,与动物模型共同推动科学研究的进展。
3.2.2 “3R”原则的践行
类器官共培养模型因其独特的生物学优势和技术创新,或可逐步实现对动物模型的替代,在实践中积极响应了实验动物伦理学的“3R”原则。类器官共培养模型以其高效、精准和人源化的特点,显著减少了实验动物的使用,并提升了实验设计的科学性和可重复性。这些优势使得类器官模型在替代、减少和优化动物实验中表现出巨大潜力。未来,随着人工智能和生物工程技术的结合,类器官模型将进一步优化其生理相关性,并可能在某些领域全面替代动物实验。总之,类器官共培养模型不仅代表了实验动物替代的未来方向,还在推动生物医学研究效率和伦理实践方面做出了重要贡献。
4 类器官共培养模型的挑战与展望
4.1 面临的挑战和解决策略
尽管类器官共培养模型在生物医学研究中展现出广泛的应用潜力,但仍面临技术和伦理方面的挑战。首先,标准化和可重复性问题限制了该模型的广泛推广。由于不同实验室之间的培养条件存在差异,实验结果的横向比较成为一大难题。为解决这一问题,需尽快建立国际统一的技术规范,包括培养液成分、基质选择和类器官形成所需的标准化操作流程。其次,利用高通量数据分析和人工智能技术,开发统一的模型表征工具,通过定量化和自动化的手段提升实验一致性。最后,在伦理层面,患者来源的肿瘤类器官(patient-derived organoids,PDOs)的研究还需面对隐私保护与数据共享的双重挑战。为此,需建立完善的伦理审批体系,并制定统一的行业标准,以确保患者样本的使用规范。
此外,跨学科协作不足和技术整合不力限制了类器官研究的创新潜力。该领域横跨生物学、工程学、医学和数据科学,然而不同学科间的知识壁垒和沟通障碍常常导致技术整合效率低下。未来,研究应着力于构建跨学科联合研究中心,推动不同领域研究人员之间的交流与合作。同时,通过学科交叉培训培养复合型人才,并开发一体化的多功能技术平台,将类器官共培养模型构建、功能分析与动态模拟统一于一个框架下,从而提升整体研究效率和创新水平。
4.2 未来研究方向
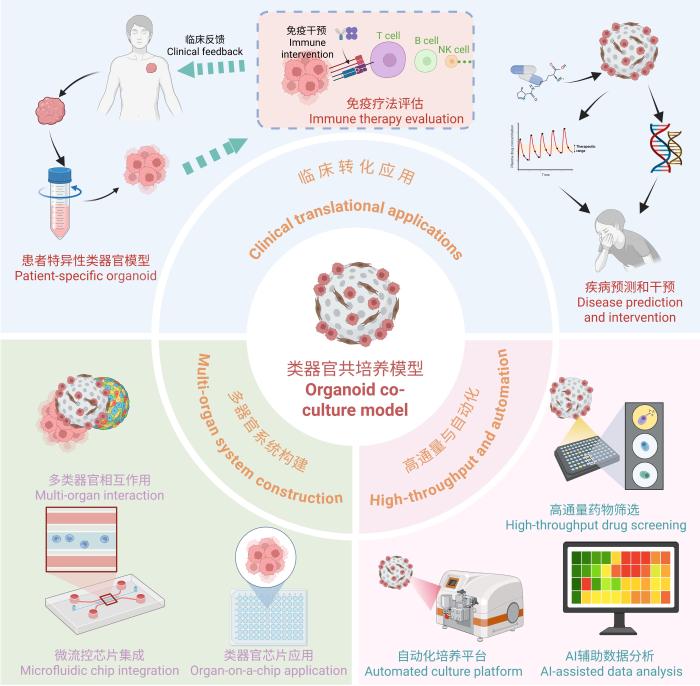
类器官共培养模型作为当代生物医学研究的重要工具,正逐步从基础研究走向更广泛的临床应用。未来的研究方向集中于通过技术创新提升模型的复杂性和功能性,如多器官系统的构建、高通量与自动化技术的整合(图2),以及加速临床转化的路径优化。
图2
图2
类器官共培养模型的未来研究方向和应用示意图
Figure 2
Schematic diagram of future research directions and applications of organoid co-culture models
4.2.1 多器官系统构建
4.2.2 高通量与自动化技术
自动化培养系统与人工智能技术的结合为类器官共培养模型的发展带来了前所未有的机遇。通过集成自动化平台与先进的计算机算法,研究者能够减少人为误差,优化数据分析,并显著提升高通量药物筛选的效率和精确性。2024年的一项研究中,展示了基于深度学习的3D图像分割、单细胞表型分类和跟踪技术,从而自动获取TME中不同相互作用细胞类型的多维动态数据。这些数据不仅可用于研究肿瘤与TME中不同细胞类型的相互作用动态,还可用于研究其他组织或器官生理学和病理学中涉及的各种细胞-细胞相互作用[47]。未来,自动化技术与人工智能的深度融合将进一步推动精准医疗和药物研发,尤其是在精准医学和靶向治疗领域。
4.2.3 实验动物学融合
类器官共培养模型与实验动物科学的融合,将成为生物医学研究的未来趋势。一方面,类器官模型可作为动物实验的前期筛选工具,显著减少实验动物使用量;另一方面,在多器官交互研究中,类器官模型可弥补动物模型在细胞和组织层面研究中的不足。通过多器官芯片技术模拟器官间的动态交互过程,再结合动物实验验证全身生理状态,可大幅提高实验数据的全面性和相关性。未来,随着人工智能和自动化技术的深度融合,类器官模型将在复杂疾病建模、药物开发和个性化医疗领域展现出更大的应用潜力,为生物医学研究的转化和创新提供有力支持。
4.2.4 临床转化
5 总结
类器官共培养模型通过再现体内3D微环境并促进多细胞间相互作用,已成为生物医学研究中的核心技术之一。这些模型能够有效模拟疾病的病理过程,为肿瘤微环境、感染性疾病及神经退行性疾病等研究领域提供关键实验平台,并在精准医疗中展现出独特的应用潜力。通过与IC、StC及微生物等的共培养,类器官模型揭示了肿瘤的免疫抑制机制,并探索了病原体与宿主细胞间的复杂交互,为制定精准干预策略奠定了基础。
尽管类器官共培养模型取得了显著进展,但其在标准化、规模化和伦理规范方面仍面临挑战。培养方法的标准化对提高实验的可重复性至关重要,而规模化培养则能支持高通量药物筛选和大规模数据分析的需求。同时,随着类脑器官技术的发展,科学进步与伦理规范之间的平衡成为亟待解决的重要议题。因此,未来的研究应着重解决这些挑战,以推动类器官共培养模型的进一步优化。
未来的研究应重点关注构建多器官系统,以重现人体复杂的生理环境,并通过建立器官间的相互作用网络,全面理解系统性疾病的发病机制。这种多器官模型能够为提出多器官综合治疗方案提供理论支持。同时,类器官共培养模型的临床前验证和转化将成为再生医学与精准医疗的研究重点,为患者提供更具针对性的治疗方案。通过克服技术和伦理挑战,该模型有望在生物医学领域释放更大的创新潜力,推动基础研究、新药研发和精准医疗的发展。
[引用本文]
谭邓旭, 马一凡, 刘可, 等. 重塑细胞间互动:类器官共培养模型赋能疾病机制与治疗探索[J]. 实验动物与比较医学, 2025, 45(3): 309-317.DOI: 10.12300/j.issn.1674-5817.2024.164.
TAN D X, MA Y F, LIU K, et al. Reshaping intercellular interactions:empowering the exploration of disease mechanisms andtherapies using organoid co-culture models[J]. Lab Anim CompMed, 2025, 45(3): 309-317. DOI: 10.12300/j.issn.1674-5817.2024.164.
作者贡献声明
谭邓旭负责检索文献、写作初稿;
马一凡参与写作初稿、提供绘图素材;
刘可负责示意图绘制;
张延英参与修订论文;
师长宏负责修订论文。
利益冲突声明
所有作者均声明本文不存在利益冲突。
参考文献
Human organoids in basic research and clinical applications
[J].
Human pluripotent-stem-cell-derived organoids for drug discovery and evaluation
[J].
Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer
[J].
Three-dimensional (3D) culture in sarcoma research and the clinical significance
[J].
Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche
[J].
Human cerebral organoids - a new tool for clinical neurology research
[J].
Human ESC-derived expandable hepatic organoids enable therapeutic liver repopulation and pathophysiological modeling of alcoholic liver injury
[J].
Organoid modeling of human fetal lung alveolar development reveals mechanisms of cell fate patterning and neonatal respiratory disease
[J].
Advances and challenges toward developing kidney organoids for clinical applications
[J].
Modeling development and disease with organoids
[J].
Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors
[J].
Engineering organoids
[J].
Human organoids: model systems for human biology and medicine
[J].
Challenges of organoid research
[J].
Human tissues in a dish: the research and ethical implications of organoid technology
[J].
Harnessing 3D in vitro systems to model immune responses to solid tumours: a step towards improving and creating personalized immunotherapies
[J].
Organoid modeling of the tumor immune microenvironment
[J].
Intestinal organoid cocultures with microbes
[J].
Immunotherapy discovery on tumor organoid-on-a-chip platforms that recapitulate the tumor microenvironment
[J].
Heart and kidney organoids maintain organ-specific function in a microfluidic system
[J].
Cancer modeling meets human organoid technology
[J].
Mimicking tumor cell heterogeneity of colorectal cancer in a patient-derived organoid-fibroblast model
[J].
Macrophage-organoid co-culture model for identifying treatment strategies against macrophage-related gemcitabine resistance
[J].
Patient-specific modeling of stroma-mediated chemoresistance of pancreatic cancer using a three-dimensional organoid-fibroblast co-culture system
[J].
Bioengineered co-culture of organoids to recapitulate host-microbe interactions
[J].
A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions
[J].
Identification of SARS-CoV-2 inhibitors using lung and colonic organoids
[J].
Toward the next generation of vascularized human neural organoids
[J].
Chimeric cerebral organoids reveal the essentials of neuronal and astrocytic APOE4 for Alzheimer's tau pathology
[J].
Disruption of lysosomal proteolysis in astrocytes facilitates midbrain organoid proteostasis failure in an early-onset Parkinson's disease model
[J].
Patient-derived organoids in translational oncology and drug screening
[J].
Delivery of a BET protein degrader via a CEACAM6-targeted antibody-drug conjugate inhibits tumour growth in pancreatic cancer models
[J].
Patient-derived organoids of bladder cancer recapitulate antigen expression profiles and serve as a personal evaluation model for CAR-T cells in vitro
[J].
Newly developed 3D in vitro models to study tumor-immune interaction
[J].
Bioengineering approaches for the pancreatic tumor organoids research and application
[J].
Thoughts on limitations of animal models
[J].
Human pathways in animal models: possibilities and limitations
[J].
Human organoids: New strategies and methods for analyzing human development and disease
[J].
Acquisition of epithelial plasticity in human chronic liver disease
[J].
Advancements in 3D in vitro models for colorectal cancer
[J].
Advanced lung organoids for respiratory system and pulmonary disease modeling
[J].
On the usefulness of animals as a model system (part I): Overview of criteria and focus on robustness
[J].
Progress and potential in organoid research
[J].
Biomimetic liver lobules from multi-compartmental microfluidics
[J].
Microengineered multi-organoid system from hiPSCs to recapitulate human liver-islet axis in normal and type 2 diabetes
[J].
Human organoids-on-chips for biomedical research and applications
[J].
Deep learning-based 3D single-cell imaging analysis pipeline enables quantification of cell-cell interaction dynamics in the tumor microenvironment
[J].
Tumor organoids: Opportunities and challenges to guide precision medicine
[J].