1 人源化小鼠培育的3次突破
复杂的生物过程通常需要在个体水平上(体内)进行研究和分析,然而基于伦理考虑,大多数介入性生物学研究并不能以人类作为实验对象。作为人类的替难者,小鼠无疑是生物学和医学领域最常用的实验动物模型。其中,免疫缺陷小鼠的出现,使得在其体内移植人体免疫组织或细胞来构建人鼠嵌合模型,即人源化小鼠成为可能。自1988年首次成功将人体造血细胞移植到重症联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠起,人源化小鼠培育历经了三十余年的发展。至今,人源化小鼠模型已成为研究人类造血功能、先天性和适应性免疫、自身免疫、传染病、癌症生物学和再生医学等领域的重要模型工具。
无胸腺裸小鼠因发生Foxn1 nu 基因纯合突变致胸腺发育不良,从而缺乏成熟的T细胞,不发生依赖T细胞的免疫排斥反应。但由于其仍具有B细胞和自然杀伤(natural killer,NK)细胞,因此无法作为人源化小鼠模型的受体动物。SCID小鼠因携带Prkdcscid 纯合突变(scid突变)导致T细胞和B细胞均存在成熟缺陷,这使得部分人体细胞可以在该小鼠体内存活。在此基础上,1988年科学家就已成功将人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)和人造血干细胞(hematopoietic stem cell,HSC)移植到SCID小鼠体内,构建了人源化SCID小鼠模型。因此,可以把SCID小鼠的出现视为人源化小鼠培育的第一个突破。
然而,基于SCID小鼠的人源化小鼠模型仍存在一些缺点:(1)植入的人体细胞在SCID小鼠体内重建水平非常低,且不能产生功能性免疫系统;(2)SCID小鼠存在“渗漏”现象,随着年龄的增长,会部分恢复T和B细胞功能;(3)SCID小鼠体内的NK细胞和其他先天免疫活性处于高水平,限制了HSC的植入成功率;(4)移植时为了清除SCID小鼠的内源性造血干细胞,需要对其进行半致死剂量的放射性辐照,而scid突变产生DNA损伤修复缺陷,会导致其抗辐照能力差。基于以上原因,在人源化小鼠的培育上还需要寻找新的突破。新的契机来自将scid突变导入到非肥胖糖尿病(non-obese diabetes,NOD)小鼠中,即第二代人源化小鼠NOD/scid小鼠的成功培育。
前文《NOD小鼠培育接力赛》[1]中已经介绍NOD小鼠不仅血糖代谢异常,还存在多种免疫缺陷(包括NK细胞和补体C5功能缺陷)。将NOD小鼠与SCID小鼠杂交,并连续回交10代以上后,可得到scid突变纯合的同源导入近交系(congenic inbred strain)NOD.Cg-Prkdcscid 小鼠(简称NOD/scid小鼠)。在遗传组成上,NOD/scid小鼠与NOD小鼠的唯一不同就在于Prkdc这个位点,前者携带纯合的scid突变,而后者是野生型[3]。NOD/scid小鼠不仅没有了NOD小鼠的自发糖尿病和胰岛炎表型,而且与包括C3H/scid、C57BL/6-scid在内的scid突变同源导入近交系小鼠和scid突变来源的CB.17/scid小鼠相比,还具有支持更高水平的人体造血细胞植入的能力。研究表明,NOD/scid小鼠的人源细胞移植效率比其他品系scid突变小鼠高5~10倍[4]。因此,可以说NOD/scid小鼠是人源化小鼠培育工作的第二个突破。
NOD/scid小鼠的培育成功不仅推动了人源化小鼠模型的广泛使用,也为进一步优化人源化小鼠提供了方向。但NOD/scid小鼠同样存在着诸多不足,主要表现为:(1)因自发淋巴瘤,平均寿命仅有8个月[5];(2)NK细胞仍具有一定活性,同时免疫“渗漏”问题也未得到解决;(3)scid突变导致抗辐照能力弱的问题依然存在。这些缺陷说明人源化小鼠模型培育工作仍有很大的提升空间。基于对免疫系统发育的理解,应用遗传操作技术构建出极重度免疫缺陷小鼠,自然而然地成为了人源化小鼠培育的第三个突破。
当给NOD/scid小鼠注射NK细胞发育相关抗体,阻断NK细胞发育后,可以提高其人体造血细胞移植水平,说明残留的NK细胞活性仍然是影响NOD/scid小鼠人造血细胞移植能力的主要因素之一[6]。如果将残余的NK细胞活性全部消除,是不是可以进一步提升NOD/scid小鼠的人类造血细胞移植能力呢?随着小鼠遗传操纵技术的成熟,科学家几乎可以构建任意基因和任意类型遗传突变的小鼠模型。在此背景下,不同突变类型的白细胞介素(interleukin,IL)-2受体(IL-2 receptor,IL-2R)γ链基因(IL2rg)敲除小鼠被相继构建成功,这为人源化小鼠培育带来了新的突破。
IL-2Rγ链是IL家族中IL-2、IL-4、IL-7、IL-9、IL-15和IL-21高亲和力受体的关键组成部分,为受体传导这些细胞因子信号发挥重要作用。IL-2Rγ链的缺失会导致T细胞、B细胞发育和功能严重受损,并完全阻止了NK细胞的发育。因此,在NOD/scid背景下通过引入IL2rg突变,就可以形成T、B和NK3种细胞功能同时缺失的小鼠。在这个思路指引下,日本东京大学和美国杰克森(Jackson)实验室先后培育了NOG、NSG和NRG等多种极重度免疫缺陷小鼠。
NSG是商品名NOD scid gamma(NSG™)的简称,其正式名称为NOD.Cg-PrdkcscidIL2rgtm1wjl/ShiLtSzJ。该小鼠是由Jackson实验室用雌性NOD/scid小鼠与雄性IL2rg基因敲除小鼠B6.129S4-IL2rgtm1Wjl/J交配,再用NOD/scid小鼠回交8代后的子代近交培育而成的同源导入近交系小鼠。NOG是NOD.Cg-PrkdcscidIL2rgtm1Sug /ShiJic简称,由日本东京大学实验动物中心培育。NOG小鼠是比NSG小鼠更早开发出来的极重度免疫缺陷小鼠,与NSG小鼠相比,最大的区别在于IL2rg位点。NOG小鼠导入了一个截短的IL2rg基因(缺乏胞内段,可以结合细胞因子,但不能传递信号),而NSG小鼠则是引入了全长IL2rg基因片段删除。除此之外,NOG小鼠培育使用的是日本保有的NOD/Shi-scid小鼠,而NSG小鼠培育使用的是Jackson实验室保有的NOD/Lt-scid小鼠。这也可能给二者带来一些差异,例如:在人体脐带血移植能力上,NSG小鼠略高于NOG小鼠;在体重上,NSG小鼠要比NOG小鼠重一些[7]。而在主要的免疫学性状上,二者高度相似,都是缺少功能性T、B和NK淋巴细胞,同时存在巨噬细胞和补体功能缺陷。
NSG和NOG小鼠很少自发淋巴瘤。现有研究数据表明,NOG和NSG小鼠的胸腺瘤发病率不足1%,而NOD/scid小鼠的胸腺瘤发病率高达67%[8]。因此,低自发淋巴瘤的NSG和NOG小鼠更加长寿,不会像NOD/scid小鼠那样只有不到8个月的寿命。需要注意的是,小鼠的IL2rg基因位于X染色体上,因此雌性NSG小鼠为IL2rgtm1Wjl纯合子,雄性小鼠为IL2rgtm1Wjl半合子。
为了解决scid突变导致小鼠抗辐照能力弱的问题,Jackson实验室又培育了NOD.Cg-Rag1 tm1MomIL2rgtm1Wjl/SzJ小鼠(简称NRG小鼠)。与NSG和NOG小鼠不同的是,NRG小鼠的T、B细胞功能缺失是由免疫细胞成熟发育的另一个关键基因——重组激活基因(recombination activating gene 1,Rag1)突变所致。由于Rag1基因突变不影响DNA损伤修复,所以NRG小鼠不存在因携带scid突变导致抗辐照能力差的问题。理论上,NRG小鼠是一种比NOG和NSG小鼠更优秀的极重度免疫缺陷小鼠[9]。
与所有先前培育的免疫缺陷小鼠模型相比,引入IL2rg基因突变的免疫缺陷小鼠极大地提高了人体造血细胞植入能力,也使得NOG、NSG和NRG等成为人源化小鼠模型构建中最常用的受体动物,它们不仅能够支持大量的人类免疫细胞长期植入和稳定存在,还能形成部分人类造血功能[10]。因此,可以把引入IL2rg null 或Rag1突变,培育出NOG、NSG和NRG等极重度免疫缺陷小鼠,视作人源化小鼠培育的第三个突破。
2 使用NOD背景品系小鼠培育的原因
在上述人源化小鼠培育过程,人们不禁要问:为何常用的极重度免疫缺陷小鼠如NSG、NOG、NRG和B-NDG等都要以NOD小鼠作为背景品系进行培育呢?
研究表明,以C57BL/6(B6)为背景品系,敲除重组激活基因(Rag2)和IL2rg得到纯合BRG小鼠(B6-Rag2 nullIL2rgnull )同样会出现T、B和NK细胞功能缺失,成为极重度免疫缺陷小鼠[11]。但使用BRG小鼠进行人类细胞(如HSC)移植造模时,其HSC定植和生长分化能力要远低于在NOD小鼠遗传背景下培育的具有相同基因突变的NRG(NOD-Rag2 nullIL2rgnull )小鼠。那么是什么原因导致了这一差异呢?
哺乳动物免疫系统中除了T、B和NK细胞外,还有一种被称为巨噬细胞的免疫细胞。它们以细胞吞噬的方式清除体内的细胞碎片、外来病原菌或异物[12]。巨噬细胞的吞噬作用受其细胞表面的各种信号分子调控。其中有一种细胞表面受体分子被称为信号调控蛋白a(signal-regulatory protein α,SIRP-α)。SIRP-α与其配体CD47结合后,会向巨噬细胞发送减少或停止吞噬的信号。CD47是HSC表面分子之一,因此,在人源化小鼠中,HSC可借助CD47与宿主巨噬细胞上的SIRP-α结合来抑制巨噬细胞的吞噬作用[13]。从免疫排斥的角度理解,亦可把CD47看作是HSC在宿主中实现“自我”身份识别的标志。这种作用机制类似于HSC向巨噬细胞发出了“别吃我”(don't eat me)的信息。因此,宿主小鼠体内巨噬细胞上的SIRP-α对HSC所携带CD47的识别能力强弱,将决定HSC的最终命运。其识别能力弱,就无法有效向巨噬细胞发送“别吃我”信号,这将导致多数HSC被巨噬细胞吞噬;其识别能力强,就能有效地发送出“别吃我”信号,得以让更多的HSC存活。
进一步的疑问是,为何NOD背景品系的小鼠可以如此高效地接收来自HSC的“别吃我”信号呢?
通过基因比对分析发现,原来NOD小鼠巨噬细胞上的SIRP-α序列非常独特。与129和B6等其他小鼠品系相比,NOD小鼠的SIRP-a蛋白序列和空间结构与人类的SIRP-a更为相似。这令NOD小鼠的SIRP-α与人源CD47的亲和力(识别能力)远高于B6等其他品系小鼠(提高10倍以上)。因此,将HSC移植到具有NOD背景的免疫缺陷小鼠体内后,“别吃我”信息传递得更高效,从而极大地降低了巨噬细胞对植入HSC的吞噬清除作用。
以同源导入的方式将NOD小鼠的SIRP-α基因(NOD SIRPα )导入到BRG小鼠,得到背景品系为B6并携带NOD-SIRPα基因的BRGS(B6-Rag2 nullIL2rgnull NOD SIRPα )小鼠[14]。该小鼠的HSC移植效率不仅远高于BRG小鼠,甚至比具有NOD背景的NRG小鼠还要高。
3 人源化免疫系统小鼠模型的培育
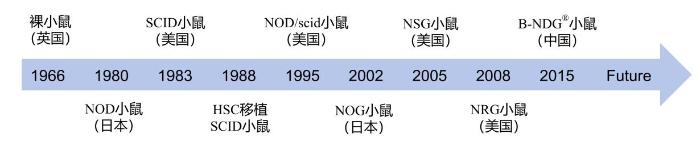
在人源化小鼠的培育上,美国和日本的科学家们一直是你追我赶又互通有无,激烈地比拼着(图1)。美国的Jackson实验室先于日本培育出了NOD/scid小鼠,但日本的东京大学却先于美国培育出了含IL2rg基因功能缺失突变的NOG小鼠(2002年日本培育出NOG小鼠,2005年美国培育出NSG小鼠),随后美国科学家们(来自Jackson实验室)又培育出了抗辐照的NRG小鼠。2015年,中国的百奥赛图公司通过基因编辑技术直接将NOD/scid小鼠的IL2rg基因敲除(大片段删除),也获得了类似NOG和NSG的极重度免疫缺陷小鼠,即NOD-PrkdcscidIL2rgtm1/Bcgen小鼠,商品名为B-NDG®。从生长曲线看,B-NDG®与NSG小鼠类似。B-NDG®的IL2rg基因突变是在NOD/scid小鼠上直接实施的,不同于通过同源导入方式引入IL2rg突变的NSG和NOG小鼠。因此,B-NDG®小鼠具有更高的NOD背景纯度。
图1
有了极重度免疫缺陷小鼠后,通过将人类免疫系统的一部分(如PBMC)移植到其(如NSG小鼠)体内即可以得到人源化PBMC(Hu-PBMC)小鼠模型。一方面,该模型的构建速度通常较快,可在较短时间内获得成熟的人类T细胞,常被用于T细胞功能研究和肿瘤免疫治疗评价;另一方面,PBMC主要以成熟的T细胞为主,因此容易引发移植物抗宿主病(graft versus host disease,GVHD),导致小鼠生存时间缩短,进而限制了其长期使用。另外,人类免疫系统的其他成分(如B细胞、巨噬细胞、NK细胞)也难以在这种模型中完全重建。
如果将HSC中的CD34+细胞移植到新生或免疫缺陷小鼠体内,就会得到Hu-CD34小鼠。相比Hu-PBMC小鼠,Hu-CD34小鼠具有更全面的免疫系统,通常会包括T细胞、B细胞、巨噬细胞和NK细胞。因此,Hu-CD34小鼠更适合用于研究复杂的免疫反应,并可以进行长期研究,适合模拟慢性传染病和癌症免疫疗法的研究。该小鼠的缺点是免疫系统重建速度较慢,通常需要几个月的时间才能获得成熟的免疫细胞;此外,人类免疫系统的重建并非总是完全成功,某些特定的免疫细胞群体可能出现功能不全的表现。
上述两种人源化小鼠模型移植的人类细胞均来自造血系统的免疫细胞,因此被称为人源化免疫系统小鼠模型。除此之外,通过将人类肝细胞移植到免疫缺陷小鼠的肝脏中,亦可以得到人源化肝脏小鼠模型。该模型可以模拟人类肝脏的药物代谢,因此,在药物代谢、毒性评价、相互作用等研究中发挥着重要应用,常被用于研究与肝脏相关的疾病,如肝炎、肝纤维化和肝癌等。但该模型也有其缺点,主要表现为小鼠的肝脏微环境与人类差别很大,移植的人类肝细胞无法完全再现其在人体中的功能;另一个缺点是肝脏人源化水平受小鼠寿命和免疫系统的限制,很难做到长期维持人类肝脏功能。
除了直接用于免疫等相关疾病研究外,通过将肿瘤患者的原代肿瘤组织移植到免疫缺陷小鼠体内,还可以获得人源化肿瘤小鼠模型,即患者来源的异种移植肿瘤(patient-derived xenograft,PDX)模型。该模型的特点是保留了人类肿瘤的绝大多数基因组和组织学特征,进而保持了移植肿瘤的异质性和患者特异性,较好地反映了人类肿瘤的生物学特征。PDX模型常被用于抗癌药物筛选和个性化癌症治疗研究,能较为准确地预测药物在人类患者中的疗效。但正是由于缺乏人类免疫系统,该模型无法用于研究肿瘤免疫反应或免疫治疗。此外,肿瘤在小鼠体内的生长环境与在人体内完全不同,因此药物反应可能也有所不同。另外,在肿瘤移植过程中,选择压力也会导致部分肿瘤特性改变,肿瘤无法完全保持其原始状态。
总而言之,尽管历经多年研究,人源化小鼠的培育得到了极大发展,也为人类疾病的研究做出了不可估量的贡献,但由于人类细胞和小鼠微环境之间存在着无法克服的物种屏障,时至今日,人源化小鼠仍然只能重构部分人体功能。这也意味着在研究某些复杂疾病和筛选新药时,必须结合更多临床与体外模型的数据来验证,从而获得更客观、全面的结论。有鉴于此,目前通过遗传操作技术将人类基因(如细胞因子、人类主要组织相容性抗原等)移植到NSG等免疫缺陷小鼠体内,实现对其微环境的改造,令其更好地支持人体功能的重建,已经成为当下人源化小鼠培育的新方向。这一做法不仅有助于人类免疫细胞的归巢和增殖,还可以在更大程度上模拟人类的免疫反应过程,为疾病机制研究及药物评估提供了更精准的动物模型。此外,读者朋友们也不妨思考一下,为何相较于NOD和NOD/scid小鼠,NSG和NOG小鼠很少自发淋巴瘤?
[引用本文]
孙强. 人源化小鼠模型培育史[J]. 实验动物与比较医学, 2025, 45(1): 112-116. DOI: 10.12300/j.issn.1674-5817.2024.154.
参考文献
NOD小鼠培育接力赛
[J].
殊途同归的免疫缺陷小鼠培育史
[J].
Improved engraftment of human spleen cells in NOD/LtSz-scid/scid mice as compared with C.B-17-scid/scid mice
[J].
High levels of human peripheral blood mononuclear cell engraftment and enhanced susceptibility to human immunodeficiency virus type 1 infection in NOD/LtSz-scid/scid mice
[J].
Immunodeficient mouse models of lymphoid tumors
[J].
Humanized mice in translational biomedical research
[J].
Comparison of biological features between severely immuno-deficient NOD/Shi-scid Il2rgnull and NOD/LtSz-scid Il2rgnull mice
[J].
Morphologic and Immunohistochemical Characterization of Spontaneous Lymphoma/Leukemia in NSG Mice
[J].
Distinct roles of RAG1 and RAG2 in binding the V(D)J recombination signal sequences
[J].
SH3RF3 promotes breast cancer stem-like properties via JNK activation and PTX3 upregulation
[J].
Communicable ulcerative colitis induced by T-bet deficiency in the innate immune system
[J].
Inherent P2X7 receptors regulate macrophage functions during Inflammatory diseases
[J].
Signal-regulatory protein α from the NOD mouse binds human CD47 with an exceptionally high affinity-- implications for engraftment of human cells
[J].
The CD47-SIRPα signalling system: its physiological roles and therapeutic application
[J].