近年来,90%以上的丙肝患者能够实现临床治愈,但乙型肝炎病毒(hepatitisBvirus,HBV)感染仍是一个困扰全球的健康问题。虽然自1982年预防性HBV疫苗应用以来,儿童的HBV感染率显著下降,但是世界卫生组织数据显示全球仍有约2.5亿人为慢性乙型肝炎(简称乙肝)患者。中国是全球慢性乙肝中高度流行地区,据统计中国慢性乙肝发病人数约930万,其中约10%~20%会发展成为肝硬化,1%~5%可演变成为肝细胞癌[1-2]。消灭HBV或已成为全球实现“2030全面消灭病毒性肝炎目标”的头等大事[3-4],也是中国医疗卫生事业面临的一个重大挑战[5]。目前,乙肝防控仍存在不少难点,其中,缺乏合适的实验动物模型一直是HBV研究领域中病毒学、免疫学和新药评价研究的瓶颈。
CBA/CaJ小鼠的B细胞、T细胞、自然杀伤细胞和粒细胞均正常[6]。与BALB/cJ、C57BL/6J和C3H/HeN等6个品系小鼠相比,HBV感染CBA/CaJ小鼠的效率不受鼠龄的影响,同时,病毒携带时限可以超过半年以上[7]。本课题组前期利用分子生物学技术体外合成HBV共价闭合环状DNA(covalently closed circular DNA,cccDNA),并通过尾静脉高压水动力注射至CBA/CaJ小鼠体内,自主研发建立了免疫功能正常的HBV cccDNA小鼠模型[8-10]。尽管已经证明这一模型具有建模方便、免疫健全、携带病毒时限超过半年,且肝细胞中含有HBV cccDNA等优点[11-14],但是该模型是否能很好地用于药物评价尚不清楚。
中药是我国医学瑰宝。已有文献报道,中药苦参碱(matrine)及青蒿素(artemisinin)在体外及体内均具有一定的抑制HBV的作用[11],但因无理想的动物模型,其药效评价指标有限。本研究应用HBV cccDNA CBA/CaJ小鼠模型,观察苦参碱和青蒿素对模型小鼠体内HBV的治疗作用,并以此评价该小鼠模型的应用价值,为应用该模型进行药效学评价研究提供理论依据。
1 材料与方法
1.1 实验动物
SPF级的8~10周龄雄性CBA/CaJ小鼠37只,体质量为22~25 g,购自重庆医科大学实验动物中心[SCXK(渝)2018-003]。动物实验操作在重庆医科大学实验动物中心屏障设施内完成,实验动物使用许可证号为SYXK(渝)2018-003。本实验方案得到重庆医科大学伦理委员会的批准(No.2015019)。
1.2 药品与主要试剂
苦参碱(批号:CAS#519-02-8)购自上海源叶生物科技有限公司;青蒿素(批号:CAS#63968-64-9)购自北京索莱宝科技有限公司;病毒基因组DNA/RNA提取试剂盒(批号:Cat.#DP315)购自天根生化科技(北京)有限公司;HBV表面抗原(HBV surface antigen,HBsAg)诊断试剂盒(国药准字S10910113)购自上海科华生物工程股份有限公司;HBsAg质控标准品[批号:GBW(E)090072]购自北京康彻思坦生物技术有限公司;马抗HBsAg多克隆抗体(ab9193)(批号:Lot. GR207325-21)和山羊抗兔IgG H&L(ab6717)(批号:A20180314314)购自英国Abcam公司;兔抗HBV核心抗原(HBV coreantigen,HBcAg)抗体(GTX40523)(批号:Lot No.82180026)购自美国GeneTex公司;辣根过氧化物酶标记的兔抗马多克隆抗体(批号:SAA544Eq09)购自美国Cloud-Clone Crop公司;T5核酸外切酶试剂盒(批号:M0363S)购自新英格兰生物(北京)有限公司;Blaze iTaqTM Universal SYBR® Green Supermix试剂盒(批号:Cat.#1725124)购自美国Bio-Rad公司。定量PCR检测引物均由重庆茂百科技有限公司合成。
1.3 实验仪器
酶标检测仪(1510-00783)购自美国Thermo Fisher Scientific公司;核酸浓度检测仪(NanoDrop 2000)购自香港基因有限公司;CFX ConnectTM Real-Time System定量PCR检测仪(788BR05039)购自美国Bio-Rad公司。
1.4 药物配制
苦参碱和青蒿素分别用二甲基亚砜溶解为无色透明的储存液(250 μg/μL),于-80℃保存。使用时按如下体积比配制药物使用质量浓度(5μg/μL):2%药物储存液,40%聚乙二醇300,2%吐温80,最后用ddH2O补足至2 mL;依次加入溶剂,每加入一种溶剂后,先充分振荡混匀,再加入下一种溶剂。
1.5 动物模型的建立与鉴定
按照本课题组之前建立的方法[8-10]制备HBV cccDNA,然后从尾静脉一次性高压注射质量浓度为1 μg /mL的HBV cccDNA于每只CBA/CaJ小鼠中,注射量为小鼠体质量的8%(约2mL),注射时间控制在6~8 s。高压注射后第1周和第8周分别采集小鼠血清,按照HBV表面抗原诊断试剂盒说明检测血清中HBsAg含量,并判断HBsAg阳性结果。第1周血清HBsAg阳性者(样本光密度值与阴性对照孔平均光密度值+0.100的比值≥1.0),初步判断为HBV小鼠感染成功;第8周检测血清HBsAg阳性,同时HBV DNA载量大于105 拷贝/mL者,判断为HBV cccDNA模型阳性,并用于后续的药物评价研究。
1.6 药物实验
成功转染HBV cccDNA后第8周(处于急性期)和第26周(处于慢性期)的小鼠分别随机分为苦参碱组、青蒿素组和生理盐水对照组。每组小鼠6只,按小鼠体质量分别腹腔注射50 μg/g苦参碱、50 μg/g青蒿素或同体积的0.9%氯化钠溶液(此时记为给药第0周),每3d给药1次,连续给药9次,共27d(约4周)。给药过程中定期进行尾静脉采血,急性期小鼠的具体采血时间点为给药前和开始给药后第1、2、3、4周,慢性期小鼠的采血时间点为给药前和开始给药后第2、4周。在最后一次收集血清后,急性期和慢性期所有小鼠经麻醉后以脱颈椎法无痛处死,收集肝组织。
1.7 实时定量PCR法检测HBV DNA和HBV cccDNA
用病毒基因组DNA/RNA提取试剂盒提取小鼠血清或肝组织中HBV总DNA。使用CFX ConnectTM Real-Time System定量PCR检测仪和Blaze iTaqTM Universal SYBR® Green Supermix试剂盒进行HBV DNA和HBV cccDNA的定量PCR检测。HBV DNA的上游引物(1493)序列为5'-TTCTCCGCCTGTCGTACC-3',下游引物(1638)序列为5'-GGTTTCTGTGGGCGTTCC-3';HBV cccDNA的上游引物(1559)序列为5'-CTTCTCATCTGCCGGACC-3',下游引物(1864)序列为5'-CACAGCTTGGAGGCTTGA-3' 。
在进行HBV cccDNA荧光定量PCR检测之前,用核酸外切酶T5处理样品,去除线性和有缺口的DNA,仅保留cccDNA,以避免细胞基因组、HBV rcDNA对cccDNA的影响,使定量检测结果更加准确。按照T5核酸外切酶试剂盒说明书,37 ℃处理1 h后,再72 ℃ 20 min,酶切结束后的产物置于-20 ℃保存备用。定量检测HBV DNA和cccDNA的PCR扩增条件如下:94 ℃预变性5 min;94 ℃变性10 s,57 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸5 min,并读取熔解曲线。定量PCR检测时使用合成的已知拷贝数的标准品(5×108拷贝)以绘制标准曲线,检测得到样本的HBV DNA或cccDNA拷贝数,然后统计学分析两个药物组与生理盐水对照组的差异。
1.8 酶联免疫吸附法检测血清中HBsAg水平
按照HBV表面抗原诊断试剂盒操作说明书步骤,采用酶联免疫吸附法检测用药后各组小鼠血清中HBsAg的水平。检测有效值的判断标准:阴性对照孔平均光密度值NCx≤0.01,阳性对照孔平均光密度值≥1,判断为检测操作有效无误;样本光密度值与COV值(COV=NCx+0.100)的比值≥1.0,判断为样本HBsAg阳性。样本HBsAg表达量的计算:用HBsAg标准质控品建立的标准曲线,按照样本光密度值和HBsAg标准曲线得到的公式计算HBsAg含量;HBsAg标准质控品的含量为4 U/mL,样本HBsAg检测时对样本进行100倍稀释,因此计算得到的样本HBsAg含量不超过有效范围,单位计为102 U/mL。
1.9 免疫组织化学法检测肝组织中HBsAg和HBcAg水平
将小鼠肝脏组织固定在4%多聚甲醛溶液中,随后进行石蜡包埋和切片。切片经过脱蜡和水化、抗原修复、抗体孵育等操作后,用DAB染色并封固,置于光学显微镜下评估。免疫组织化学法检测肝组织中HBsAg和HBcAg所使用的抗体(工作液稀释比例)分别为:马抗HBsAg(1∶100)和兔抗HBcAg(1∶200)一抗,兔抗马IgG(1∶200)和山羊抗兔IgGH&L(1∶50)二抗。免疫组织化学检测结果可示HBsAg表达在细胞质,HBcAg表达在细胞核;相应定位若在显微镜下观察到棕褐色,则为抗原阳性信号。
1.10 统计学处理
采用SPSS 22.0统计学软件进行实验结果数据分析。所有实验至少独立重复3次,结果数据以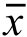 ±s表示。多组比较采用方差分析,组内两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
±s表示。多组比较采用方差分析,组内两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 动物模型建立成功
一共注射37只CBA/CaJ小鼠,尾静脉高压注射HBV cccDNA后第8周检测小鼠血清中HBsAg和HBV DNA含量。将HBsAg阳性且HBV DNA载量大于105拷贝者,判定为HBV cccDNA模型阳性。结果显示,HBV cccDNA模型阳性小鼠有36只,建模阳性率为97.30%(36/37)。
2.2 HBV感染急性期苦参碱和青蒿素的抑制作用
2.2.1 急性期给药过程中小鼠血清HBsAg的表达
HBV感染急性期(即转染HBV cccDNA后第8周)小鼠在苦参碱和青蒿素给药前(第0周)及给药后第1、2、3、4周,酶联免疫吸附法检测小鼠血清中HBsAg的表达水平(图1A)。结果显示,苦参碱和青蒿素对HBV cccDNA模型小鼠急性期HBsAg具有明显的抑制效果,但前3周与生理盐水对照组相比差异没有统计学意义,仅在第4周HBsAg水平才明显降低(P<0.05)。
2.2.2 急性期给药过程中小鼠血清HBV DNA的拷贝情况
对HBV感染急性期小鼠,采用实时定量PCR法检测苦参碱和青蒿素给药前及给药后第4周的小鼠血清中HBV DNA含量(图1B)。结果显示,用药后第4周,HBV cccDNA模型小鼠血清中HBV DNA拷贝数比生理盐水对照组明显减少(P<0.01)。
2.3 HBV感染慢性期苦参碱和青蒿素的抑制作用
2.3.1 慢性期给药过程中小鼠血清HBsAg的表达
小鼠转染HBV cccDNA后第26周即携带HBV至26周,进入HBV感染慢性期,这时用同样的浓度和方法给予小鼠苦参碱和青蒿素治疗,并在给药前及给药后第2周和第4周各进行一次尾静脉采血,然后采用酶联免疫吸附法检测小鼠血清中HBsAg水平(图2A)。结果显示,无论是第2周或第4周,与相应的生理盐水对照组相比,HBsAg变化均不明显(均P>0.05)。
同时,分析用药前HBsAg绝对值与用药后第4周HBsAg绝对值之差,计算出相对降低水平(即ΔHBsAg),其结果如图2B所示。结果表明,用药后第2周,两个药物组和生理盐水对照组的ΔHBsAg无明显差异(均P>0.05);但是,用药后第4周,与生理盐水对照组的ΔHBsAg相比,苦参碱组和青蒿素组的ΔHBsAg均存在明显差异(均P<0.05)。
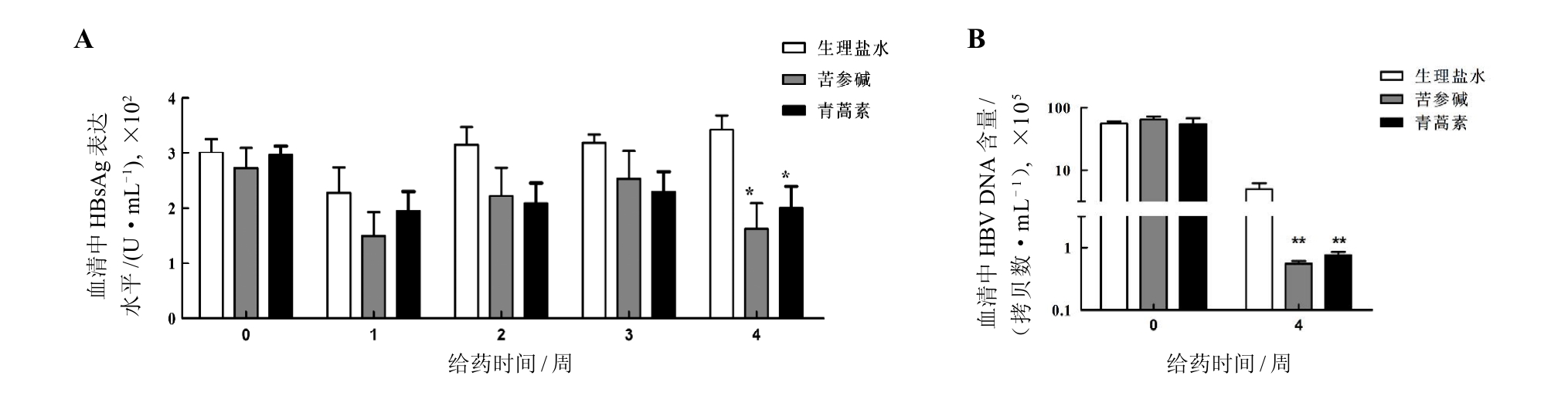
图1 急性期CBA/CaJ小鼠经苦参碱或青蒿素治疗后血清HBsAg(A)和HBV DNA水平(B)的变化
Figure 1 Serum HBsAg (A) and HBV DNA (B) levels in CBA/CaJ mice during acute phase after matrine or artemisinin treatment
注:HBV cccDNA转染后第8周即急性期,HBsAg是乙型肝炎病毒表面抗原,HBV是乙型肝炎病毒。与生理盐水对照组相比,各用药组 *P<0.05,**P<0.01;每组6只小鼠。
2.3.2 慢性期给药过程中小鼠血清及肝脏HBV DNA和HBV cccDNA拷贝数变化
在HBV感染慢性期,给药后第4周收集小鼠血清及肝脏等样本,分别提取病毒基因组DNA,采用实时定量PCR法检测各组小鼠血清中HBV DNA(图3A)以及肝组织中HBV DNA和HBV cccDNA(预先进行T5酶切处理)的拷贝情况(图3B)。结果表明,苦参碱能明显降低小鼠血清或肝组织中HBV DNA的拷贝数(P<0.05,P<0.01),也能明显降低小鼠肝组织中HBV cccDNA的拷贝数(P<0.05);但是,青蒿素仅对血清中HBV DNA有明显抑制作用(P<0.05),而对肝组织中HBV DNA和HBV cccDNA作用均无明显影响(均P>0.05)。
2.3.3 慢性期给药过程中小鼠肝组织HBsAg和HBcAg的表达
免疫组织化学法检测给药后HBV感染慢性期小鼠肝组织中HBsAg和HBcAg的表达情况,结果显示,生理盐水对照组和苦参碱、青蒿素给药组中均能观察到HBsAg和HBcAg阳性表达(图4A)。对观察到的阳性信号数量进行统计分析,结果(图4B)显示,苦参碱对HBsAg和HBcAg,以及青蒿素对HBsAg作用均不明显(均P>0.05);但是,青蒿素对HBcAg表达有明显的抑制作用(P<0.05)。
综上,HBV cccDNA转染后HBV感染急性期和慢性期小鼠模型经苦参碱和青蒿素治疗后,各药物对HBV主要标志物有不同程度的抑制效果(表1)。
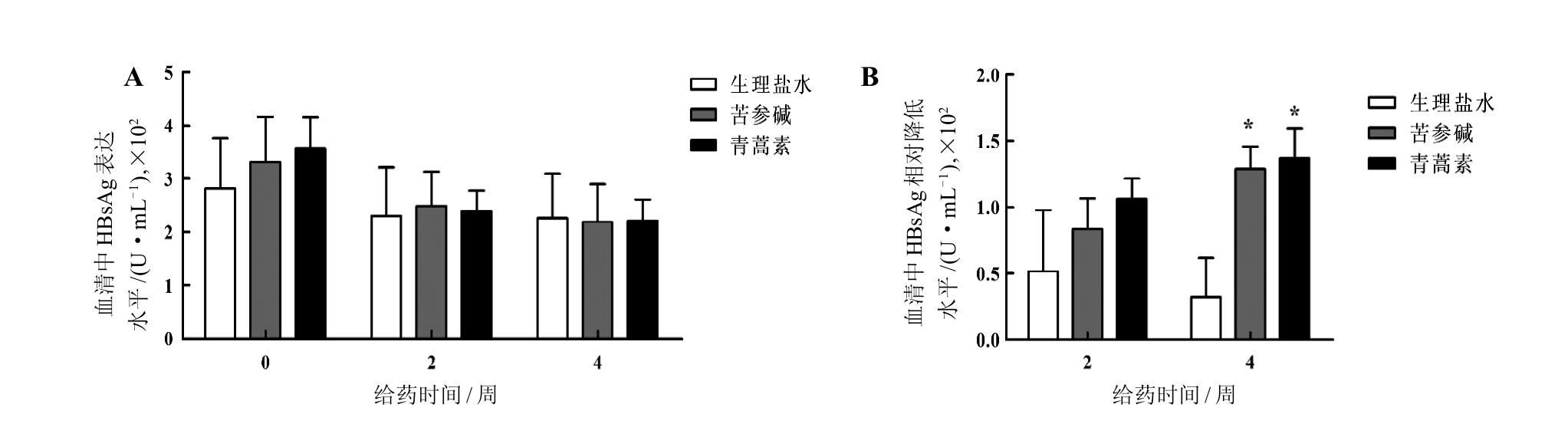
图2 慢性期CBA/CaJ小鼠经苦参碱或青蒿素治疗后血清中HBsAg水平变化(A)及相对降低水平(B)
Figure 2 Serum HBsAg level (A) and decrease (B) in CBA/CaJ mice during chronic phase after matrine or artemisinin treatment
注:HBV cccDNA转染后第26周即慢性期。HBsAg是乙型肝炎病毒表面抗原,HBV是乙型肝炎病毒。与生理盐水对照组相比,各用药组 *P<0.05;每组6只小鼠。
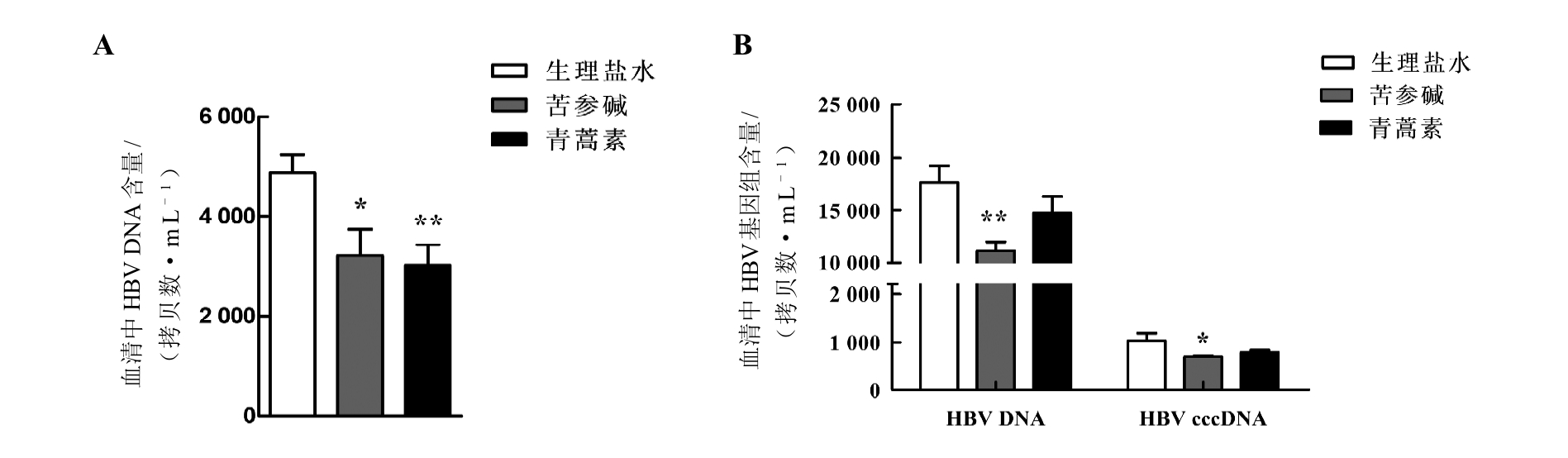
图3 慢性期CBA/CaJ小鼠经苦参碱或青蒿素治疗后血清(A)及肝脏(B)中HBV DNA或HBV cccDNA拷贝数
Figure 3 The copy number of HBV DNA or cccDNA in serum (A) and liver tissues (B) of CBA/CaJ mice during chronic phase after matrine or artemisinin treatment
注:HBV cccDNA转染后第26周即慢性期。HBV是乙型肝炎病毒,cccDNA指共价闭合环状DNA。与生理盐水对照组相比,用药组*P<0.05,**P<0.01;每组6只小鼠。
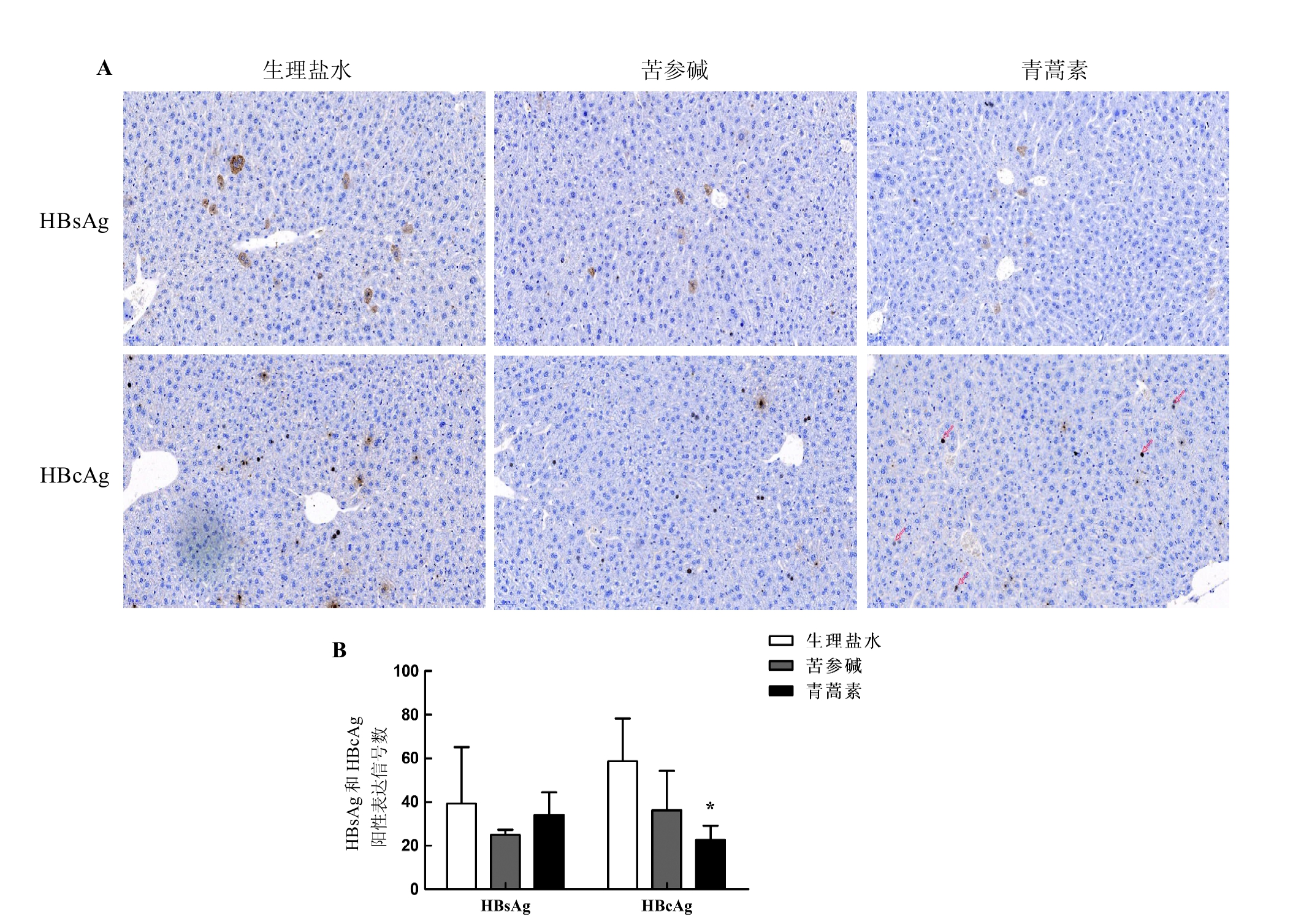
图4 免疫组织化学法检测慢性期CBA/CaJ小鼠经苦参碱或青蒿素治疗后肝组织中HBsAg和HBcAg的表达水平(DAB染色,×200)(A)及其阳性信号数量统计结果(B)
Figure 4 Immunohistochemical detection of the expression levels (DAB staining, ×200) (A) and the number of positive signals (B) of hepatitis B virus surface antigen (HBsAg) and hepatitis B virus core antigen (HBcAg) in liver tissues of CBA/CaJ mice during chronic phase after matrine or artemisinin treatment
注:HBV cccDNA转染后第26周即慢性期。HBsAg为乙型肝炎病毒(HBV)表面抗原,HBcAg为HBV核心抗原。与生理盐水对照组相比,用药组*P<0.05;每组6只小鼠。
表1 HBV cccDNA转染小鼠模型给药4周后苦参碱和青蒿素对HBV的抑制效果评价
Table 1 Inhibitory effects of matrine and artemisinin on HBV in HBV cccDNA mouse model after 4 weeks of administration
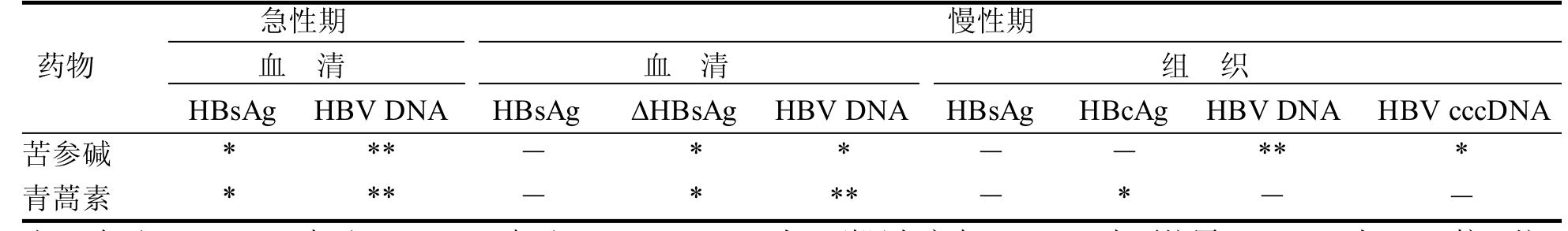
注: *表示P<0.05; **表示P<0.01; -表示P>0.05; HBsAg为乙型肝炎病毒(HBV)表面抗原,HBcAg为HBV核心抗原,ΔHBsAg表示HBV相对表面抗原表达水平。
急性期 慢性期 药物 血 清 血 清 组 织HBsAg HBV DNA HBsAg ΔHBsAg HBV DNA HBsAg HBcAg HBV DNA HBV cccDNA苦参碱******--** ***--- ***- *-青蒿素
3 讨论
苦参碱是从豆科槐属植物苦参中分离出来的一种单体化合物,有效成分为生物碱,具有抗炎、抗病毒及抗肿瘤等药理作用[12-13]。迄今,在抑制HBV作用方面,临床试验结果显示,苦参碱单独或联合其他药物能抑制肝细胞表达和分泌HBsAg,并抑制HBV DNA复制[6, 15-17]。尽管苦参碱已被应用于慢性乙肝治疗,但其更多的功能并不清楚。而来源于黄花蒿的青蒿素,在抑制HBV的作用方面目前报道较少。Romero等[11]利用HepG22.2.15细胞模型,初步证明青蒿素与拉米夫定联合使用具有协同抗HBV的作用。因此,青蒿素作为抗HBV感染的抗病毒药物值得进一步评价。
HBV的HBsAg和(或)HBV DNA在动物体内存在时间超过6个月时,即由急性HBV感染转为慢性HBV感染[18]。另外,HBV感染免疫系统发育完善的成年人后,90%的成年人只是一过性感染,即表现为急性感染。而母婴传播导致新生儿HBV感染时,由于新生儿免疫功能尚未发育完善,不能清除母亲传染给的HBV,90%的新生儿会在感染超过6个月时发展成为慢性乙肝[19]。因此,探索不同时期的药物作用效果,对指导临床用药具有十分重要的意义。
近年来,HBsAg定量检测已在临床中被广泛应用,其水平可以反映疾病分期与疾病进展风险。HBV DNA定量主要用于评估HBV感染者体内的病毒复制水平,是抗病毒治疗适应症选择及疗效判断的重要指标。另外,HBcAg在区分疾病分期、预测肝细胞癌发生风险方面是一个重要的相关性指标[18]。同时,cccDNA是HBV进入细胞、建立感染后进行复制和增殖的直接模板[20],是现有的抗病毒药物治疗亦难以清除的主要遗传物质[21],也是乙肝药物研究的“终极”靶点[22]。因此,检测上述指标可有效评估药物的作用效果。
本研究首先应用课题组前期建立的技术体系,高压注射体外合成的HBV cccDNA于37只免疫功能正常的CBA/CaJ小鼠尾静脉后,发现HBsAg阳性且HBV DNA大于1×105 拷贝/mL的小鼠有36只,模型成功率达97.30%。随后的实验结果证实,该模型的HBV标志物,尤其是HBV cccDNA均能表达,病毒携带时限可长达半年以上,与前期实验结果[8-10]一致。该模型的成功建立,为后续药效评价奠定了基础。
随后,本课题组将36只HBV cccDNA阳性小鼠模型分成HBV感染急性期和HBV感染慢性期,系统观察苦参碱和青蒿素对HBV主要标志物的抑制效果。在感染急性期,苦参碱和青蒿素既能够明显抑制血清中HBsAg的分泌,又能降低血清HBV DNA的复制;结果提示,苦参碱和青蒿素对HBV感染急性期的患者作用明显。在感染慢性期,苦参碱和青蒿素能明显降低血清中ΔHBsAg及HBV DNA水平;前者结果未见报道,而后者与以往文献报道的体外实验结果及临床结果[6, 11, 22-24]基本一致。同时本研究还发现,在感染慢性期,苦参碱和青蒿素对血清和肝组织中HBsAg的抑制作用不明显;这与已报道的临床结果[6, 22-24]有一定差异,可能是本研究中生理盐水对照组与两个药物组的起始HBsAg水平不一致所致。进一步观察苦参碱和青蒿素对肝组织中HBV标志物的作用,结果发现,苦参碱和青蒿素对HBsAg均无明显作用。更有趣的是,本研究还发现苦参碱和青蒿素对HBV的作用效果是不同的:苦参碱能有效抑制HBV DNA和HBV cccDNA,而对HBcAg无明显抑制作用;相反,青蒿素能有效抑制HBcAg,而对HBV DNA和HBV cccDNA无明显抑制作用。以上研究结果提示:苦参碱和青蒿素在小鼠体内对肝组织中的HBV有一定程度的抑制作用,同时两种药物的抗HBV作用机制可能存在一定差异。
综上所述,本研究首次应用免疫正常的HBV cccDNA转染小鼠模型在急性感染期和慢性感染期进行了苦参碱和青蒿素抗HBV有效性评价的示范研究,结果发现苦参碱和青蒿素对HBV均有不同程度的抑制作用,这一结果与以往文献报道[23-24]基本一致。除此之外,本研究结果还丰富了苦参碱和青蒿素对HBV感染慢性期肝组织中标志物cccDNA、HBcAg等的作用功效评价数据,为使用苦参碱和青蒿素进行抗HBV治疗提供了新的理论依据。后续本课题组还将充分利用该小鼠模型的优势进一步开展药物作用机制,尤其是免疫机制的研究,以期为HBV急性感染期和慢性感染期药物评价提供更多数据支持。
[1]JIA L Y, GAO Y N, HE Y W, et al. HBV induced hepatocellular carcinoma and related potential immunotherapy[J]. Pharmacol Res, 2020, 159:104992.DOI:10.1016/j.phrs.2020.104992.
[2]European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398.DOI:10.1016/j.jhep.2017.03.021.
[3]LIU J, LIANG W N, JING W Z, et al. Countdown to 2030:eliminating hepatitis B disease, China[J]. Bull World Health Organ, 2019, 97(3):230-238. DOI:10.2471/BLT.18.219469.
[4]SMITH S, HARMANCI H, HUTIN Y, et al. Global progress on the elimination of viral hepatitis as a major public health threat: an analysis of WHO Member State responses 2017[J]. JHEP Rep, 2019, 1(2):81-89. DOI:10.1016/j.jhepr.2019.04.002.
[5]CHEN Z C, ENGLE R E, SHEN C H, et al. Distinct disease features in chimpanzees infected with a precore HBV mutant associated with acute liver failure in humans[J].PLoS Pathog, 2020, 16(8):e1008793. DOI:10.1371/journal.ppat.1008793.
[6]王冠蕾, 富大智. 苦参碱与恩替卡韦联合介入治疗乙肝肝癌的临床疗效分析[J]. 贵州医药, 2018, 42(4):420-422.DOI:10.3969/j.issn.1000-744X.2018.04.013.
[7]CHOU H H, CHIEN W H, WU L L, et al. Age-related immune clearance of hepatitis B virus infection requires the establishment of gut microbiota[J]. Proc Natl Acad Sci USA,2015, 112(7):2175-2180. DOI:10.1073/pnas.1424775112.
[8]CAO M, ZHAO Z H, TANG Y W, et al. A new hepatitis B virus e antigen-negative strain gene used as a reference sequence in an animal model[J]. Biochem Biophys Res Commun, 2018, 496(2):502-507. DOI:10.1016/j.bbrc.2018.01.081.
[9]LIU Y, ZHAO Z H, LV X Q, et al. Precise analysis of the effect of basal core promoter/precore mutations on the main phenotype of chronic hepatitis B in mouse models[J/OL]. J Med Virol (2020-05-19) [2021-01-02]. https://doi.org/10.1002/jmv.26025.
[10]WANG L, CAO M, WEI Q L, et al. A new model mimicking persistent HBV e antigen-negative infection using covalently closed circular DNA in immunocompetent mice[J]. PLoS One, 2017, 12(4):e0175992. DOI:10.1371/journal.pone.0175992.
[11]ROMERO M R, EFFERTH T, SERRANO M A, et al.Effect of artemisinin/artesunate as inhibitors of hepatitis B virus production in an “in vitro” replicative system[J].Antiviral Res, 2005, 68(2):75-83. DOI:10.1016/j.antiviral.2005.07.005.
[12]SHI J F, HAN X, WANG J F, et al. Matrine prevents the early development of hepatocellular carcinoma like lesions in rat liver[J]. Exp Ther Med, 2019, 18(4):2583-2591. DOI:10.3892/etm.2019.7875.
[13]GONG X B, GAO Y, GUO G Q, et al. Effect of matrine on primary human hepatocytes in vitro[J]. Cytotechnology,2015, 67(2):255-265. DOI:10.1007/s10616-013-9680-1.
[14]BLAZQUEZ A G, FERNANDEZ-DOLON M,SANCHEZ-VICENTE L, et al. Novel artemisinin derivatives with potential usefulness against liver/colon cancer and viral hepatitis[J]. Bioorg Med Chem, 2013, 21(14):4432-4441. DOI:10.1016/j.bmc.2013.04.059.
[15]唐超, 马军伟, 刘辉, 等. 恩替卡韦联合苦参碱对慢性乙型肝炎的疗效及对炎症因子水平的影响[J]. 西北药学杂志, 2019, 34(5):673-676.
[16]孔李远, 孔维环, 赵莉. 苦参碱联合恩替卡韦对慢性乙肝患者肝纤维化的影响[J]. 中国实用医刊, 2020, 47(8):108-110. DOI:10.3760/cma.j.cn115689-20191218-09088.
[17]陈俊平. 苦参素注射液联合恩替卡韦治疗乙肝肝硬化患者的疗效评价[J]. 内蒙古医学杂志, 2020, 52(9):1095-1096. DOI:10.16096/J.cnki.nmgyxzz.2020.52.09.049.
[18]王贵强, 王福生, 庄辉, 等. 慢性乙型肝炎防治指南(2019年版)[J]. 中国病毒病杂志, 2020, 10(1):1-25.DOI:10.16505/j.2095-0136.2019.0097.
[19]INDOLFI G, EASTERBROOK P, DUSHEIKO G, et al.Hepatitis B virus infection in children and adolescents[J].Lancet Gastroenterol Hepatol, 2019, 4(6):466-476. DOI:10.1016/S2468-1253(19)30042-1.
[20]POLLICINO T, CAMINITI G. HBV-integration studies in the clinic: role in the natural history of infection[J].Viruses, 2021, 13(3):368. DOI:10.3390/v13030368.
[21]YANG H C, KAO J H. Persistence of hepatitis B virus covalently closed circular DNA in hepatocytes: molecular mechanisms and clinical significance[J]. Emerg Microbes Infect, 2014, 3(9): e64. DOI:10.1038/emi.2014.64.
[22]AHMED M, WANG F, LEVIN A, et al. Targeting the Achilles heel of the hepatitis B virus: a review of current treatments against covalently closed circular DNA[J]. Drug Discov Today, 2015, 20(5):548-561. DOI:10.1016/j.drudis.2015.01.008.
[23]LAM W Y, LEUNG K T, LAW P T, et al. Antiviral effect of Phyllanthus Nanus ethanolic extract against hepatitis B virus (HBV) by expression microarray analysis[J]. J Cell Biochem, 2006, 97(4):795-812. DOI:10.1002/jcb.20611.
[24]CUI X, WANG Y, KOKUDO N, et al. Traditional Chinese medicine and related active compounds against hepatitis B virus infection[J]. Biosci Trends, 2010, 4(2):39-47.